Pubblichiamo una prima traduzione del contratto tra Pfizer e lo Stato del Sud Africa rilasciato dopo la decisione del tribunale chiesta dall’azione di Health Justice Iniziative (https://healthjusticeinitiative.org.za/) Abbiamo deciso di lasciare i numeri di pagina in modo che se volete possiate reperire l’originale più facilmente. Lo trovate qui: https://healthjusticeinitiative.org.za/wp-content/uploads/2023/09/OCRPfizer-1_Redacted.pdf
ACCORDO DI PRODUZIONE E FORNITURA TRA
PFIZER LABORATORIES LIMITED PROPRIETARIO
E
IL GOVERNO DELLA REPUBBLICA DEL SUDAFRICA AGIRE ATTRAVERSO IL DIPARTIMENTO NAZIONALE DELLA SALUTE DEL SUDAFRICA (“NDOH”)
DATATA
30 marzo 2021
Pagina I di 46
CONTRATTO DI PRODUZIONE E FORNITURA
IL PRESENTE CONTRATTO DI PRODUZIONE E FORNITURA datato 30 marzo 2021 (il “Data di entrata in vigore”) è stipulato da e tra PFIZER LABORATORIES (PROPRIETARY) LIMITED con uffici in 85 Bute Lane, Sandton, Johannesburg, Sud Africa (di seguito “Pfizer”) e il Governo della Repubblica del Sud Africa che agisce attraverso il Dipartimento Nazionale di Health of South Africa (“NDOH”), con sede presso Dr AB Xurna Building, I I I 2 Voortrekker Rd, Pretoria Townlands 351-JR, Pretoria, O187 (di seguito “Acquirente”).
L’Acquirente e Pfizer possono essere qui indicati singolarmente come la “Parte” o collettivamente come le “Parti”.
PREMESSO CHE Pfizer Inc. (“Pfizer US”) e BioNTech SE, una società organizzata ed esistente secondo le leggi tedesche (“BioNTech”), stanno collaborando per sviluppare un vaccino per affrontare la pandemia globale di COVID-19;
PREMESSO CHE, subordinatamente al successo clinico, Pfizer US e BioNTech saranno responsabili di tutti i requisiti dei processi di approvazione delle sperimentazioni cliniche e dell’autorizzazione all’immissione in commercio del Prodotto;
PREMESSO CHE l’Acquirente desidera acquistare il Prodotto per l’utilizzo in Sud Africa (il “Tenetorio”) e, soggetto al successo clinico e all’approvazione normativa, Pfizer desidera produrre e fornire tale Prodotto all’Acquirente; e
PREMESSO CHE le Parti sono disposte a eseguire quanto sopra in conformità ai termini e alle condizioni stabiliti nel presente Contratto.
QUINDI, in considerazione di tali premesse e dei patti e accordi ivi stabiliti, la cui sufficienza è qui riconosciuta e concordata, e intendendo essere legalmente vincolate da ciò, le Parti convengono quanto segue:
l. DEFINIZIONI.
Come utilizzati nel presente Contratto, i seguenti termini avranno i significati indicati di seguito.
1.1 “Programma di consegna modificato” avrà il significato stabilito nella Sezione 2.4(e).
1.2 “Pagamento Anticipato” avrà il significato indicato f01th nella Sezione Errore! Fonte di riferimento non trovata..
1.3 “Affiliato(i)” indica, rispetto a ciascuna Parte o, se applicabile, BioNTech, qualsiasi società, azienda, partnership o altra entità o Persona che controlla direttamente o indirettamente o è controllata da o è sotto controllo comune! con la Parte indicata, inclusa, a titolo esemplificativo, Pfizer US o, se applicabile, BioNTech. Ai fini di tale definizione, si presume che esistano “contrai” (compresi, con correlativo significato, i termini “controllato da” e “sotto comune controllo!”) se è soddisfatta una delle seguenti condizioni: (a) nel caso di entità societarie, l’amministratore possiede la proprietà indiretta di almeno il cinquanta per cento (50%) delle azioni o delle azioni aventi diritto di voto per l’elezione degli amministratori di tale entità societaria o qualsiasi amministratore controllante indiretto di tale entità societaria, e (b) in il caso di non-
Pagina 2 di46
entità societarie, proprietà diretta o indiretta di almeno il cinquanta per cento (50%) della partecipazione con il potere di dirigere la gestione e le politiche di tali entità non societarie.
1.4 “Contratto” indica il presente Contratto di produzione e fornitura e tutti i suoi allegati poiché gli stessi possono essere modificati, emendati e riformulati, integrati o altrimenti sostituiti di volta in volta.
1.5 “Assegnazione” avrà il significato stabilito nella Sezione 2.S(a).
1.6 Per “Autorizzazione” si intende l’Approvazione Condizionata o l’Autorizzazione all’Immissione in Commercio.
1.7 “Lotto” avrà il significato indicato nell’Allegato B.
1.8 “BioNTech” avrà il significato indicato nei presupposti.
1.9 Per “Term Sheet vincolante” si intende il term sheet vincolante stipulato da e tra le Parti il 15 gennaio 2021.
I. IO Per “Giorno lavorativo” si intende qualsiasi giorno diverso dal sabato, dalla domenica o da un giorno festivo a New York, New York o Johannesburg.
1.11 Per “Sforzi commercialmente ragionevoli” si intende, rispetto agli sforzi compiuti da Pfizer per raggiungere l’obiettivo rilevante, le attività e il grado di sforzo che una parte con una posizione simile (rispetto alle dimensioni, alle risorse e ai beni) nell’industria farmaceutica utilizzerebbe raggiungere un obiettivo simile nel proprio interesse commerciale in circostanze simili e considerando i rischi, le incertezze, i limiti e le sfide rilevanti dello sviluppo, della produzione, della commercializzazione e della distribuzione di un nuovo prodotto vaccinale contro il COVID-19, tenendo conto dei seguenti fattori: e potenziali problemi di sicurezza ed efficacia, novità, profilo del prodotto, posizione proprietaria, ambiente competitivo allora attuale per tale Prodotto, probabile tempistica dell’ingresso del Prodotto nel mercato, contesto normativo e status del Prodotto, conformità alle Leggi, prestazioni passate del Prodotto e di altri prodotti simili, la capacità di produrre o ottenere una fornitura adeguata del Prodotto o qualsiasi componente o materiale utilizzato nella fabbricazione del Prodotto e altri fattori scientifici, tecnici, operativi e commerciali rilevanti, in ciascun caso misurati in base ai fatti e alle circostanze al momento in cui tali sforzi sono dovuti.
1.12 Per “Approvazione condizionata” si intende un’autorizzazione condizionata all’immissione in commercio per il Prodotto concessa dall’Autorità di regolamentazione dei prodotti sanitari sudafricani (“SAHPRA”) e concordata con Pfizer, che consente la fornitura del Prodotto in Sud Africa.
1.13 Per “Informazioni riservate” si intendono tutte le informazioni riservate o proprietarie, diverse dalle Informazioni esenti, in qualsiasi forma, divulgate direttamente o indirettamente al Ricevente o ai suoi rappresentanti da o per conto della Parte divulgante ai sensi del presente Accordo, indipendentemente dal modo in cui tali le informazioni vengono divulgate, consegnate, fornite, apprese o osservate, contrassegnate come “Riservate” o, se ora!, dichiarate riservate quando divulgate e confermate per iscritto entro trenta (30) giorni dalla divulgazione. Le informazioni riservate includono, senza limitazione, i termini e le condizioni del presente Contratto.
Pagina 3 di 46
Il mancato contrassegno delle Informazioni riservate divulgate per iscritto di seguito come “Confidenziali” non farà sì che le informazioni siano considerate non riservate, con l’onere della Parte divulgante di dimostrare che tali informazioni avrebbero dovuto essere chiaramente conosciute da una persona ragionevole con esperienza in materia la questione, in base alla natura delle informazioni e alle circostanze della loro divulgazione, deve essere considerata un’informazione riservata, a condizione che la parte divulgante abbia altrimenti compiuto sforzi in buona fede per contrassegnare chiaramente le informazioni riservate come tali.
1.14 “Dosi contrattate” avrà il significato stabilito nella Sezione 2.3(a).
1.15 “Covax Facility” indica il meccanismo di approvvigionamento globale per l’approvvigionamento e la consegna di dosi di vaccino approvato per COVID-19.
l.16 Per “correnti buone pratiche di fabbricazione” o “cGMP” si intendono le buone pratiche di fabbricazione applicabili come specificato nel Codice dei regolamenti Federai degli Stati Uniti e/o nelle Linee guida di buona fabbricazione dell’UE e in qualsiasi legislazione successiva di volta in volta prevalente in quel momento della fabbricazione del Prodotto.
1.17 “Prezzo di consegna” avrà il significato stabilito nella Sezione 3.2(a).
1.18 “Specifiche di consegna” avrà il significato stabilito nella Sezione 2.4(d).
1.19 “Parte Divulgante” indica la Parte o una delle sue Affiliate che divulga, o fa sì che siano divulgate, Informazioni riservate all’altra Parte o a una qualsiasi delle sue Affiliate.
1.20 “Data di entrata in vigore” avrà il significato indicato nel preambolo.
1.21 Per “Informazioni Esenti” si intendono le informazioni che: (a) la Parte Ricevente o uno dei suoi Rappresentanti possedeva legittimamente, come dimostrato da prove competenti, prima che la Parte Divulgante divulgasse tali informazioni ai sensi del presente Accordo; o (b) era già generalmente disponibile e di pubblico dominio al momento della divulgazione, o diventa pubblico (a meno che non sia il risultato di una violazione del presente Contratto da parte della Parte ricevente o dei suoi Rappresentanti);
(e) la Ricevente o uno qualsiasi dei suoi Rappresentanti ottiene legalmente da una Persona che non viola alcun obbligo di riservatezza (o altro divieto di divulgare le informazioni) alla Parte Divulgante in relazione a tali informazioni (e la Ricevente ha effettuato ragionevoli indagini in merito ); o (d) le prove della Parte ricevente con ragionevole soddisfazione della Parte divulgante sono sviluppate in modo indipendente da o per conto della Parte ricevente o dei suoi rappresentanti senza l’uso, il riferimento, l’aiuto o l’affidamento sulle Informazioni riservate. Per chiarire quanto sopra, una divulgazione generale di pubblico dominio non farà sì che informazioni più specifiche (ma correlate) siano considerate Informazioni Esenti in base a una delle eccezioni di cui sopra; allo stesso modo, una combinazione di severa! parti di informazioni, che individualmente sarebbero considerate Informazioni Esenti, non saranno considerate Informazioni Esenti a meno che la combinazione stessa non sia di dominio pubblico, sviluppata in modo indipendente dalla Ricevente o dai suoi Rappresentanti o altrimenti legalmente in possesso della Ricevente o di uno qualsiasi dei suoi Rappresentanti .
Pagina 4 di 46
1.22 Per “Strutture” si intendono gli stabilimenti produttivi di Pfizer a Kalamazoo (Michigan) e Puurs, in Belgio, e i due stabilimenti produttivi di BioNTech, a Magonza e Idar Oberstein in Germania o qualsiasi altro sito produttivo utilizzato in relazione alla fabbricazione del Prodotto fornito da Pfizer ai sensi del presente documento.
1.23 “Evento di forza maggiore” avrà il significato stabilito nella Sezione 12.8.
1.24 “Moduli” avrà il significato stabilito nella Sezione 12.12.
1.25 “Governo” indica tutti i livelli e le suddivisioni del governo (ad esempio locale, regionale, nazionale, provinciale, federale, amministrativo, legislativo o esecutivo) del Sud Africa.
1.26 “ICC” avrà il significato stabilito nella Sezione 12.2.
1.27 “Reclami non indennizzati” avrà il significato stabilito nella Sezione 8.2.
1.28 Gli “indennizzati” avranno il significato di cui alla Sezione 8.1.
1.29 “Programma di consegna provvisorio” avrà il significato stabilito nella Sezione 2.4(d).
1.30 Per “proprietà intellettuale” si intende (a) qualsiasi processo, segreto commerciale, invenzioni, modelli industriali, progetti, metodologie, disegni, scoperte, risultati, materiali, formule, procedure, tecniche, cliniche! dati o informazioni tecniche o di altro tipo, disegni di produzione, ingegneristici e tecnici, compresi i diritti di proprietà su quanto sopra, e (b) marchi registrati, domande di marchio commerciale, marchi non registrati, immagini commerciali, copyright, know-how, brevetti, domande di brevetto, e tutti i provvisori, divisioni, continuazioni, continuazioni parziali, estensioni, sostituzioni, rinnovi, registrazioni, riconvalide, riemissioni o aggiunte, compresi i certificati di protezione supplementare, di o di uno qualsiasi dei suddetti brevetti e domande di brevetto, e tutti controparti straniere di uno qualsiasi dei suddetti brevetti e domande di brevetto.
1.31 “Specifiche di etichettatura e imballaggio” avrà il significato stabilito nella Sezione 2.4(e).
1.32 Per “Difetto latente” si intende un difetto che rende il Prodotto non conforme alle Specifiche applicabili, che l’Acquirente può dimostrare essere presente al momento della consegna del Prodotto da parte di Pfizer all’Acquirente e che non avrebbe potuto essere rilevato dall’Acquirente, dal suo designato o da loro Personale alla consegna tramite diligente ispezione.
1.33 Per “Legge/i” si intendono, collettivamente, tutte le leggi nazionali e locali applicabili, le leggi comuni, gli statuti, le ordinanze, i codici, le norme, i regolamenti, gli ordini, i decreti o altre dichiarazioni di qualsiasi autorità governativa, amministrativa o giudiziaria aventi effetto di legge.
1.34 “Perdite” avrà il significato stabilito nella Sezione 8.1.
1.35 “Autorizzazione all’immissione in commercio” indica l’autorizzazione all’immissione in commercio o altro permesso avente effetto simile, in relazione al Prodotto, concessa dall’Autorità di regolamentazione dei prodotti sanitari sudafricani, come modificata o variata dall’Autorità di regolamentazione dei prodotti sanitari sudafricani
Pagina 5 di 46
di volta in volta dall’Autorità di regolamentazione e che sia accettabile per Pfizer; che consente al Prodotto di essere immesso sul mercato in Sud Africa secondo la Legge.
1.36 “Prodotto non conforme” avrà il significato stabilito nella Sezione 4.4(a).
1.37 “Parte” o “Parti” avrà il significato esposto in premessa.
1.38 Per “Persona” si intende qualsiasi persona fisica, entità, società, società in nome collettivo, società in accomandita semplice, società a responsabilità limitata, joint venture o entità o organizzazione simile, società per azioni, proprietà intellettuale, altra organizzazione commerciale, trust, sindacato, associazione o governo.
1.39 Per “Personale” si intendono tutti gli Affiliati, i subappaltatori o altre terze parti, nonché i dipendenti e gli agenti di ciascuno di essi, utilizzati da ciascuna delle Parti nell’esecuzione di servizi o obblighi o in relazione al presente Contratto.
1.40 “Pfizer” avrà il significato esposto in premessa.
1.41 “Pfizer US” avrà il significato stabilito nel preambolo.
1.42 “Prezzo” avrà il significato stabilito nella Sezione 3.1.
1.43 “Privilegi e immunità” indica qualsiasi privilegio, immunità o legislazione nella Repubblica del Sud Africa, inclusi, senza limitazione, programmi di compensazione vaccinale senza colpa, programmi assicurativi contro la pandemia, immunità da azioni legali o responsabilità, o qualsiasi protezione, difesa o limitazioni di responsabilità (sia statutarie, regolamentari, di diritto comune o altro), esistenti o future, che potrebbero proteggere separatamente gli Indennizzati dalle Perdite.
1.44 “Prodotto” significa la medicina! il prodotto è BNT162b2, un vaccino con RNA messaggero (mRNA) modificato con nucleosidi che codifica una glicoproteina (S) di punta a lunghezza intera ottimizzata per SARS-CoV-2 in una via multidose congelata senza conservanti (che deve essere diluita, per la quale è stata concessa l’autorizzazione o è richiesto, per la prevenzione del COVID-19, comprese eventuali successive variazioni non materiali come ragionevolmente determinato da Pfizer e approvato dall’autorità di regolamentazione competente. A scanso di equivoci, modifiche al principio attivo o alle caratteristiche antigeniche di BNTl 6262 che codifica un variante o nuovo ceppo di SARS-CoV-2 nonché qualsiasi nuova formulazione di BNTI 6262 sono esplicitamente esclusi dall’ambito del “Prodotto” come qui definito, così come qualsiasi altra modifica significativa del prodotto che Pfizer possa ragionevolmente determinare.
1.45 Per “Materiali del Prodotto” si intendono tutti i materiali di imballaggio e i componenti necessari per la consegna del Prodotto.
1.46 “Ordine d’acquisto” indica un modulo d’ordine scritto o elettronico inviato dall’Acquirente a Pfizer in conformità con i termini del presente Contratto che autorizza la produzione e la fornitura del Prodotto, sostanzialmente nel formato allegato come Allegato G (come aggiornato di volta in volta tempo da parte di Pfizer previa comunicazione all’Acquirente).
1.47 “Acquirente” avrà il significato esposto in premessa.
Pagina 6 di 46
1.48 “Destinatario” indica la Parte che riceve Informazioni Riservate dall’altra Parte.
1.49 “Recorcls” indica libri, documenti e altri dati, tra tutte le questioni relative all’adempimento degli obblighi previsti dal presente Contratto.
1.50 “Rappresentanti” indica, rispetto alla Ricevente, alle sue affiliate e ai rispettivi direttori, funzionari e dipendenti, agenti, appaltatori, consulenti, consiglieri e rappresentanti che (a) sono soggetti a un obbligo di riservatezza proteggendo le Informazioni riservate su termini non meno restrittivi di quelli contenuti nel presente Contratto; e (b) hanno la necessità di conoscere le Informazioni riservate in relazione al presente Contratto.
1.51 Per “Specifiche” si intendono le specifiche materiali relative alla produzione, lavorazione, imballaggio, etichettatura, test e procedure di collaudo, spedizione, stoccaggio e fornitura del Prodotto come saranno riportate nell’Allegato A successivamente alla Data di Efficacia (e in ogni caso prima della fornitura in conformità al Programma di consegna provvisorio concordato), e poiché tali specifiche potranno essere modificate, integrate o altrimenti modificate da Pfizer e comunicate all’Acquirente.
1.52 “Imposte” avrà il significato stabilito nella Sezione 3.4.
1.53 “Termine”, rispetto al presente Contratto, avrà il significato stabilito nella Sezione 6. l.
1.54 “Beneficiario terzo” o “Beneficiari terzi” avrà il significato stabilito nella Sezione 12.S(a).
1.55 “USD” indica la valuta avente corso legale negli Stati Uniti d’America.
1.56 “Vaccino” includerà (a) tutti i vaccini prodotti, in tutto o in parte, o forniti, direttamente o indirettamente, da o per conto di Pfizer o BioNTech o di qualsiasi loro affiliata destinati alla prevenzione della malattia umana COVID -19 o qualsiasi altra malattia umana, in ogni caso causata dal virus SARS-CoV-2 e/o da uno o tutti i ceppi, mutazioni, modifiche o derivati di quanto sopra correlati forniti dall’Acquirente e dalle sue affiliate o agenti con qualsiasi mezzo (ai sensi del Contratto o tramite qualsiasi acquisto o donazione da parte di terzi o in altro modo, autorizzati o meno ai sensi della Sezione 2.1) o che siano amministrati all’interno del Territorio, e se procurati o amministrati prima di o in seguito all’esecuzione del presente Contratto, (b) qualsiasi dispositivo, tecnologia o prodotto utilizzato nella somministrazione o per migliorare l’uso o l’effetto di tale vaccino, (e) qualsiasi componente o materiale costituente di (a) o (b), o (d) qualsiasi uso o applicazione di qualsiasi prodotto di cui ai punti (a)-(b).
1.57 “IVA AT” indica l’imposta sul valore aggiunto.
Salvo laddove il contesto richieda espressamente diversamente, (a) l’uso di qualsiasi genere nel presente documento si riterrà comprendere riferimenti a uno o entrambi i generi, e l’uso del singolare si riterrà includere il plurale (e viceversa), (b ) le parole “include”, “include” e “incluso” saranno considerate seguite dalla frase “senza limitazioni”, (c) la parola “will” sarà interpretata come se avesse lo stesso significato ed effetto di
Pagina 7 di 46
la parola “deve”, (d) qualsiasi definizione o riferimento a qualsiasi accordo, strumento o altro documento nel presente documento dovrà essere interpretato come riferito a tale accordo, strumento o altro documento come di volta in volta modificato, integrato o altrimenti modificato (soggetto a eventuali restrizioni su tali emendamenti, integrazioni o modifiche stabilite nel presente documento), (e) qualsiasi riferimento nel presente documento a qualsiasi persona dovrà essere interpretato in modo da includere i successori e gli aventi causa della persona, (f) le parole “nel presente”, “del presente” e “di seguito” , e parole di significato simile, dovranno essere interpretati come riferiti al presente Contratto nella sua interezza e non a qualsiasi disposizione particolare dello stesso, (g) tutti i riferimenti alle Sezioni o agli Allegati nel presente documento dovranno essere interpretati come riferimento alle Sezioni o agli Allegati del presente Contratto, e i riferimenti al presente Accordo includono tutti gli allegati allo stesso, (h) la parola “avviso” indica un avviso in forma scritta (indipendentemente dal fatto che sia specificato o meno) e includerà avvisi, consensi, approvazioni e altre comunicazioni scritte previste dal presente Accordo, (i) riferimenti a qualsiasi una legge, una norma o un regolamento specifico, o un articolo, una sezione o altra divisione dello stesso, si riterrà includere le modifiche in vigore allo stesso o qualsiasi legge, norma o regolamento sostitutivo o successivo e (i) il termine “o” sarà interpretato in il senso inclusivo comunemente associato al termine “e/o”.
2. FORNITURA DEL PRODOTTO.
2.1 Contratto di Fornitura.
(a) Durante il Periodo, Pfizer farà ogni sforzo commercialmente ragionevole per fornire o avrà fornito il Prodotto all’Acquirente, e l’Acquirente acquisterà il Prodotto, soggetto e in conformità con i termini e le condizioni del presente Contratto.
(b) L’Acquirente riconosce e accetta che (i) gli sforzi di Pfizer per sviluppare e produrre il Prodotto sono di natura ambiziosa e soggetti a rischi e incertezze significativi e (ii) il fatto che qualsiasi altro farmaco o vaccino per prevenire, trattare o curare il COVID -19 l’infezione viene sviluppata con successo o viene concessa l’autorizzazione prima della concessione dell’autorizzazione per il Prodotto non cambierà l’attuale situazione di urgenti necessità di prevenzione della diffusione dell’infezione da COVID-19 che pone gravi minacce ed effetti dannosi sulla vita e sulla salute della popolazione.
(e) Nonostante gli sforzi e le eventuali date stimate stabilite nel Programma di consegna provvisorio, le Parti riconoscono che il Prodotto ha completato gli studi clinici di Fase 2b/3 e che, nonostante gli sforzi di Pfizer nella ricerca, nello sviluppo e nella produzione, il Il prodotto potrebbe non avere successo a causa di problemi o guasti tecnici, clinici), normativi, di produzione, di spedizione, di conservazione o di altro tipo.
(d) Di conseguenza, Pfizer e le sue Affiliate non avranno alcuna responsabilità per l’eventuale mancato sviluppo o ottenimento dell’Autorizzazione del Prodotto da parte di Pfizer o delle sue Affiliate in conformità con le date stimate descritte nel presente Contratto. Anche se il Prodotto viene sviluppato con successo e ottiene l’autorizzazione, Pfizer non avrà alcuna responsabilità per la mancata consegna delle dosi in conformità con le date di consegna stimate stabilite nel presente documento (diverse da quanto espressamente stabilito nel presente Contratto), né tale mancata darà luogo a L’Acquirente ha ogni diritto di effettuare ordini per qualsiasi quantità di Prodotto.
Pagina 8 di 46
Inoltre, Pfizer non avrà alcun obbligo di consegnare il Prodotto all’Acquirente a meno che e fino a quando l’Accordo di indennizzo non venga stipulato tra le Parti in conformità alla Sezione 8 (Indennizzo).
(e) Pfizer terrà l’Acquirente informato del progresso dello sviluppo materiale del Prodotto e fornirà all’Acquirente le informazioni relative a tale sviluppo come l’Acquirente ragionevolmente richiede.
(f) L’Acquirente, inclusa qualsiasi Persona correlata o qualsiasi agente dell’Acquirente, si impegna a ottenere esclusivamente tutta la sua fornitura di qualsiasi vaccino di Pfizer, BioNTech o delle loro rispettive Affiliate destinato alla prevenzione della malattia umana COVID-19 (incluso il Prodotto) (i) direttamente da Pfizer o da Pfizer attraverso l’impianto COVAX, o (ii) da una terza parte, tramite donazione, rivendita o altro, solo se l’Acquirente ha ottenuto il previo consenso scritto di Pfizer. Qualsiasi violazione della presente Sezione 2.1(f) sarà considerata una violazione materiale insanabile del presente Contratto e Pfizer potrà risolvere immediatamente il presente Contratto ai sensi della Sezione 6.2. Per chiarezza, nulla nella presente Sezione 2.l(f) impedirà all’Acquirente di acquistare prodotti vaccinali concorrenti di qualsiasi Terza Società.
2.2 Capacità.
Pfizer farà ogni sforzo commercialmente ragionevole per costruire o ottenere la capacità produttiva necessaria per produrre e fornire il Prodotto all’Acquirente in conformità con le disposizioni del presente Contratto.
2.3 Ordini di acquisto.
(a) Alla Data di entrata in vigore, l’Acquirente dovrà presentare a Pfizer uno o più ordini di acquisto legalmente vincolanti e irrevocabili per ventimilionicentocinquanta (20.001.150) dosi (“Dosi contrattate”) del Prodotto. Fatta salva la Sezione 2.4(c) del presente Contratto, Pfizer avrà il diritto, a sua esclusiva discrezione, di aggiornare le Dosi Contrattate al numero più vicino possibile divisibile per la Quantità Minima di Ordine.
(b) L’Ordine di Acquisto dovrà essere fornito insieme al numero d’ordine, al numero di partita IVA e all’indirizzo di fatturazione dell’Acquirente. Pfizer accetterà per iscritto l’Ordine di Acquisto in conformità ai termini stabiliti nel presente Contratto e l’Ordine di Acquisto confermato sarà vincolante per le Parti e soggetto ai termini e alle condizioni stabiliti nel presente Contratto.
(e) L’Acquirente può richiedere dosi aggiuntive durante la Durata del Contratto tramite uno o più Ordini di Acquisto legalmente vincolanti e irrevocabili, ma solo dopo essere stato informato che: (i) Pfizer ha la disponibilità di fornitura di tali dosi aggiuntive richieste (” Ordine Aggiuntivo”) e (ii) Pfizer si impegna, a sua esclusiva discrezione, ad assegnare tale Ordine Aggiuntivo all’Acquirente. Ciascun Ordine Aggiuntivo sarà soggetto agli stessi termini e condizioni stabiliti nel Contratto (e eventuali successive modifiche allo stesso), a seconda dei casi; a condizione che tale Ordine Aggiuntivo debba essere effettuato durante la Durata del Contratto. In tal caso, le dosi soggette all’
Pagina 9 di 46
L’ordine aggiuntivo accettato sarà costituito da dosi contrattate. Dopo l’invio e l’accettazione da parte di Pfizer di un Ordine aggiuntivo, l’Acquirente dovrà corrispondere a Pfizer tale pagamento anticipato aggiuntivo entro trenta (30) giorni dall’ordine di acquisto di tale Ordine aggiuntivo in conformità con i termini della Sezione 3.2 (“Pagamento anticipato aggiuntivo” ). L’Acquirente dovrà pagare tale Pagamento Anticipato Aggiuntivo e Pfizer fornirà un Allegato B aggiornato per riflettere tale Ordine Aggiuntivo. Il pagamento integrale del Pagamento Anticipato Aggiuntivo è una condizione per la fornitura delle dosi soggette all’Ordine Aggiuntivo. Se il mancato pagamento da parte dell’Acquirente del pagamento anticipato aggiuntivo comporta un ritardo nella consegna, le dosi non consegnate saranno a rischio esclusivo dell’Acquirente e Pfizer non avrà alcuna responsabilità nei confronti dell’Acquirente in merito a tale ritardo o ulteriore incapacità di fornitura da parte di Pfizer.
2.4 Programma di consegna.
(a) Pfizer consegnerà la Consegna del Prodotto presso luogo di destinazione e (“DAP”) lncoterms 2020.
(b) Le Parti concorderanno ragionevolmente, per iscritto, il/i luogo/i (incluso il numero di luoghi) per la consegna delle spedizioni del Prodotto (“Luogo/i di destinazione”) entro cinque (5) giorni lavorativi dall’Effettivo Data per la prima spedizione prevista del Prodotto e per qualsiasi consegna successiva, almeno otto (8) settimane prima della spedizione del Prodotto; a condizione che, in ciascun caso: (i) ciascun Luogo di destinazione soddisfi i requisiti stabiliti nell’Allegato D, e (ii) il/i Luogo/i di destinazione siano serviti da un vettore di trasporto convenzionato con Pfizer, e (iii) ciascun Luogo di Destinazione è un luogo autorizzato a ricevere il Prodotto, prova della quale dovrà essere presentata a Pfizer su carta intestata ufficiale dell’Acquirente e l’Acquirente dovrà fornire eventuali informazioni aggiuntive, come ragionevolmente richiesto da Pfizer prima della consegna, per verificare tale autorizzazione (“Agente di Spedizione”) . Pfizer avrà la possibilità, agendo ragionevolmente, di limitare il numero di Luoghi di destinazione in cui dovranno essere consegnate le spedizioni del Prodotto. Tuttavia, le Parti convengono che l’Acquirente avrà la piena responsabilità per qualsiasi ulteriore trasporto e distribuzione successivo alla consegna al Luogo di Destinazione che non sia un punto di utilizzo del Prodotto, incluso ma non limitato a garantire la conformità all’Allegato D. Ai fini del presente Sezione 2.4(b), Pfizer si impegna a fornire all’Acquirente le informazioni che Pfizer ritiene necessarie affinché l’Acquirente rispetti le disposizioni di questa sezione, nella misura in cui Pfizer può controllarlo! e/o possesso in quel momento, compresi i dettagli sullo Spedizioniere proposto come parte delle informazioni di pianificazione logistica di Pfizer.
(c) Tutte le spedizioni di Prodotto dovranno comprendere una quantità di Prodotto in incrementi di 195 fiale/1170 dosi (“Quantità minima ordinabile”). Pfizer avrà il diritto di aggiornare di tanto in tanto tale Quantità Minima di Ordine a sua esclusiva discrezione previa comunicazione all’Acquirente.
(d) Pfizer potrà consegnare il Prodotto in rate separate e utilizzerà sforzi commercialmente ragionevoli per rispettare il programma di consegna stimato indicato nell’Allegato B (il “Programma di consegna provvisorio”), a condizione che nessun Prodotto sarà spedito fino a! L’autorizzazione viene ricevuta e l’Acquirente è conforme, a discrezione di Pfizer, a
Pagina 10 di 46
i termini e le condizioni del presente Contratto. Tutte le consegne dovranno essere accompagnate dalla documentazione specificata nell’Allegato C (che potrà essere aggiornato di volta in volta da Pfizer previa comunicazione all’Acquirente) e dovranno essere conformi e soggette alle specifiche di consegna stabilite nell’Allegato D (come aggiornato di volta in volta da Pfizer previa comunicazione all’Acquirente) (“Specifiche di consegna”).
(e) Il Prodotto dovrà essere etichettato e imballato in conformità con le specifiche di imballaggio di cui all’Allegato E (che dovranno essere compilate dopo la Data di entrata in vigore, ma in ogni caso prima della fornitura in linea con il Programma di consegna provvisorio concordato, e come può essere aggiornato di volta in volta da Pfizer previa comunicazione all’Acquirente) (“Specifiche di etichettatura e imballaggio”).
(f) Se un’Autorizzazione viene concessa dopo il 15 febbraio 2021 ma prima del 30 settembre 2021, il Programma di consegna provvisorio sarà rivisto per includere il periodo di tempo tra il 15 febbraio 2021 e la data dell’Autorizzazione (“Programma di consegna adeguato”). Nel caso in cui l’Autorizzazione venga concessa prima del 15 febbraio 2021, Pfizer non ha l’obbligo di accelerare la spedizione del Prodotto.
(g) Se l’Autorizzazione viene ricevuta entro il 30 settembre 2021, ma Pfizer non è in grado di consegnare alcuna Dose Contrattata per motivi tecnici o di altro tipo dalle Strutture destinate a produrre le Dosi Contrattate ai sensi del presente Contratto, Pfizer si impegna a compiere sforzi commercialmente ragionevoli per ottenere la fornitura di il Prodotto da un altro luogo, soggetto alla disponibilità di fornitura.
(h) Se l’autorizzazione viene ricevuta entro il 30 settembre 2021, ma entro il 31 marzo 2022 Pfizer non è in grado di produrre o consegnare alcuna dose Contraeteci per motivi tecnici o di altro tipo da qualsiasi struttura, Pfizer non avrà alcun obbligo di consegna rispetto al programma di consegna provvisorio, modificato Programma di consegna o ordine di acquisto.
2.5 Carenza di prodotti.
(a) Se viene ricevuta l’autorizzazione ma la fornitura non è sufficiente per consegnare l’intero numero di dosi contrattualmente previste nel programma di consegna provvisorio (incluso il programma di consegna modificato), anche nella misura in cui l’eventuale carenza sia dovuta all’esigenza di Pfizer di deviare la fornitura disponibile del Prodotto verso un altro mercato, Pfizer lavorerà in modo collaborativo per fornire avvisi (e gestire eventuali comunicazioni associate a eventuali scarti del Prodotto). Dopo aver ricevuto tale notifica, l’Acquirente dovrà eseguire tempestivamente (e in ogni caso non più di 24 ore) tutte le istruzioni stabilite nell’avviso. Fatto salvo quanto sopra, inclusa qualsiasi richiesta da parte di Pfizer di dirottare il Prodotto verso un altro mercato, Pfizer deciderà gli adeguamenti necessari al numero di dosi contrattate e al programma di consegna provvisorio dovuti all’Acquirente per riflettere tali carenze sulla base dei principi che saranno determinati da Pfizer nelle circostanze allora esistenti (“Assegnazione”) che saranno indicati in tale avviso . Si riterrà che l’Acquirente acconsenta a qualsiasi revisione.
Pagina 11 di 46
(b) L’Acquirente rinuncia a tutti i diritti e rimedi di cui potrebbe disporre per legge, in via equitativa o in altro modo, derivanti da o relativi a: (i) qualsiasi mancato sviluppo o ottenimento dell’autorizzazione del Prodotto da parte di Pfizer in conformità alle date stimate descritte nel presente Accordo; o (ii) qualsiasi mancata consegna da parte di Pfizer delle Dosi Contrattuali in conformità al Programma di Consegna Intermedio. In caso di incoerenza tra le disposizioni della presente Sezione 2.5 (Carenze di prodotti) e quelle di altre sezioni del presente Contratto, le disposizioni della presente Sezione 2.5 (Carenze di prodotti) prevarranno! e sostituiscono quelle di altre sezioni del presente Contratto nella misura di tale incoerenza.
2.6 Ritardi nella consegna.
In nessun caso Pfizer sarà soggetta o responsabile di penalità per ritardata consegna.
2.7 Movimentazione del prodotto.
(a) Pfizer farà ogni sforzo commercialmente ragionevole per garantire che il Prodotto sia fabbricato in conformità alle Specifiche dei materiali e alle cGMP.
(b) Al momento della consegna del Prodotto all’Acquirente nel/i Luogo/i di destinazione e, nella misura applicabile, per qualsiasi distribuzione successiva e/o trasporto in un Luogo di destinazione che non sia un punto di utilizzo del Prodotto, l’Acquirente dovrà conservare e movimentare il Prodotto secondo le modalità indicate nelle Specifiche, nelle istruzioni dell’Allegato D e nelle istruzioni fornite da Pfizer per garantire la stabilità e l’integrità del Prodotto.
(e) A scanso di equivoci, l’Acquirente dovrà sostenere tutte le spese per l’utilizzo del Prodotto al momento della consegna da parte di Pfizer nel/i Luogo/i di destinazione, comprese, ma non limitate a, quelle per la conservazione del Prodotto e la distribuzione e amministrazione del Prodotto (se applicabile) in Sud Africa.
(d) L’Acquirente sarà l’unico responsabile della corretta conservazione, movimentazione, distribuzione, trasporto, amministrazione, uso e smaltimento del Prodotto in Sud Africa dopo la consegna del Prodotto all’Acquirente o al suo designato nel Luogo(i) di destinazione. Fatta salva la generalità di quanto sopra, l’Acquirente dovrà garantire che: (a) i destinatari del Prodotto seguano le istruzioni di restituzione e smaltimento di cui all’Allegato F (che potranno essere aggiornate di volta in volta da Pfizer previa comunicazione all’Acquirente) quando smaltiscono Prodotto aperto e non utilizzato e relativi componenti dell’imballaggio; e (b) tale restituzione e smaltimento siano conformi alle leggi relative ai rifiuti farmaceutici, ai rifiuti sanitari o ai rifiuti pericolosi, a seconda dei casi. L’Allegato F prevede la possibilità per Pfizer di addebitare all’Acquirente il costo di tali componenti di imballaggio, senza limitare eventuali altri rimedi a disposizione di Pfizer, nel caso in cui l’Acquirente non rispetti l’obbligo di restituzione stabilito nell’Allegato F.
(e) L’Acquirente sarà responsabile e dovrà garantire che tutte le apparecchiature utilizzate per consegnare il Prodotto, ad esempio lo spedizioniere e i dispositivi di monitoraggio, siano conservate in un luogo adeguato, pulito e sicuro per proteggere e mantenere la funzionalità
Pagina 12 di 46
di tali apparecchiature (in condizioni controllate, senza esposizione ad agenti atmosferici o parassiti, ecc.). Entro trenta (30) giorni dalla consegna del Prodotto al Luogo(i) di destinazione, soggetto alla Sezione 4.4(b), l’Acquirente dovrà organizzare la restituzione sicura di tutte tali apparecchiature, compreso lo spedizioniere e il dispositivo di monitoraggio, in conformità con l’Allegato F .
(f) Pfizer può fornire Schede Dati di Sicurezza e altre informazioni all’Acquirente per assisterlo nello sviluppo di processi e procedure, inclusa la formazione, per gestire il Prodotto e i Materiali del Prodotto in modo sicuro e in conformità con le Leggi, comprese le Leggi sulla salute e sicurezza sul lavoro. L’Acquirente dichiara e garantisce che ha e dovrà garantire che tutti i destinatari del Prodotto e dei Materiali del Prodotto abbiano le competenze necessarie per sviluppare e implementare
procedure e programmi di formazione per consentire la corretta gestione del Prodotto e dei Materiali del Prodotto in modo sicuro e legale.
2.8 Proprietà del Prodotto, Rischio di Perdita.
(a) La proprietà del Prodotto e il rischio di perdita o danno passeranno all’Acquirente nel/i Luogo/i di destinazione in conformità alla Sezione 2.4(b). Pfizer si riserva il diritto di modificare qualsiasi punto di fornitura (essendo il punto da cui Pfizer fornirà il Prodotto) dandone adeguato preavviso all’Acquirente come accettabile ai sensi delle Leggi. I prezzi sono quotati in base al Luogo(i) di destinazione DAP in vigore al momento e al(i) Luogo(i) di destinazione. Ai fini del presente Contratto, i termini DAP avranno il
significato ad esso attribuito negli rNCOTERMS 2020 pubblicati dall’ICC, Parigi, Francia.
(b) Pfizer sarà l’importatore del Prodotto di fronte alle autorità doganali nel Territorio (“Importatore registrato”) e sarà responsabile di ottenere, ove applicabile, qualsiasi licenza di importazione o altra autorizzazione ufficiale e di espletare tutte le formalità doganali per l’importazione del Prodotto in Sud Africa. Pfizer sarà inoltre tenuta a pagare, ove applicabile, dazi, tasse ed altri oneri, nonché le spese per l’espletamento delle formalità doganali dovute all’importazione dei Prodotti. Data la natura del Prodotto, l’Acquirente si impegna a supportare Pfizer e lo Spedizioniere incaricato per sdoganare rapidamente il Prodotto dalle competenti autorità doganali entro ventiquattro (24) ore dall’arrivo del Prodotto presso le autorità doganali, e per ottenere eventuali deroghe necessario; e l’Acquirente riconosce che qualsiasi ritardo in tale processo di sdoganamento potrebbe influire sulla durata di conservazione complessiva dei Prodotti. Entrambe le Parti confermano che i documenti necessari per lo sdoganamento del Prodotto sono indicati nell’Allegato H del presente Contratto. Fatta salva la generalità di quanto sopra, l’Acquirente si impegna ad adottare misure adeguate e ad esercitare i propri sforzi ragionevoli per garantire il passaggio regolare ed efficiente del Prodotto attraverso il porto di ingresso in conformità con le leggi applicabili del Sud Africa.
(e) L’Acquirente sarà responsabile dello scarico di tale Prodotto dal vettore. Per motivi di chiarezza, l’Acquirente sarà responsabile dello scarico del Prodotto dal vettore di trasporto e la responsabilità di Pfizer sarà
Pagina 13 di 46
cessata, e il rischio di perdita o danno si trasferisce, all’arrivo del vettore nel/i Luogo/i di Destinazione e immediatamente prima dello scarico del Prodotto. Fatta salva la generalità di quanto sopra, dopo la consegna del Prodotto all’Acquirente, l’Acquirente sarà pienamente responsabile in relazione a qualsiasi spreco del Prodotto e per garantire uno smaltimento adeguato in conformità con le Sezioni 2.7(d) e 2.7(e) . Pfizer non sarà responsabile per eventuali rischi di perdita o danneggiamento del Prodotto dopo la consegna del Prodotto nel/i Luogo/i di destinazione, ·inclusi, a titolo esemplificativo, sbalzi di temperatura, furto o danni di qualsiasi tipo al Prodotto.
(d) Fatto salvo l’errore di sezione! Fonte di riferimento non trovata. L’Acquirente riconosce che Pfizer non accetterà, in nessun caso, alcuna restituzione del Prodotto (o di qualsiasi dose). In particolare, dopo aver ricevuto il Prodotto in conformità alla presente Sezione 2.8, in nessun caso potrà avvenire la restituzione del Prodotto (compresi futuri cambiamenti di stock, Prodotti scaduti, modifiche nell’allocazione dei Prodotti, consegna, domanda o lancio di nuovi prodotti).
3. PREZZO E PAGAMENTO.
3.1 Prezzo d’acquisto.
L’Acquirente dovrà acquistare il Prodotto da Pfizer al prezzo per dose indicato nell’Allegato B, IVA esclusa (il “Prezzo”) e in conformità con i termini del presente Contratto. Il Prezzo includerà tutti i costi interni di Pfizer associati alla produzione e alla consegna del Prodotto al Luogo(i) di destinazione in conformità al presente Contratto. Il Prezzo sarà fisso per la Durata.
3.2 Fatture e Pagamento.
(a) In considerazione parziale delle Dosi contratte, alla Data di entrata in vigore, Pfizer fatturerà all’Acquirente, e l’Acquirente dovrà pagare, un pagamento anticipato di quaranta milioni duemilatrecento dollari statunitensi (40.002.300 USD) (calcolati come due (2) USD per dose moltiplicata per le Dosi Contrattuali) (il “Pagamento Anticipato”). L’Acquirente dovrà pagare il Pagamento Anticipato entro trenta (30) giorni dalla Data di Efficacia; a condizione, tuttavia, che Pfizer non abbia alcun obbligo di consegnare alcun Prodotto fino al ricevimento del Pagamento Anticipato da parte di Pfizer. Tutti gli importi dovuti ai sensi del presente verranno convertiti in Rand sudafricano che sarà determinato in base al tasso di cambio utilizzato da Bloomberg BFIX alla chiusura delle attività del giorno precedente alla data della fattura alle 16:00, ora di Londra.
(b) Pfizer fatturerà all’Acquirente il resto del Prezzo per le Dosi Contrattuali (il “Prezzo di Consegna”) in anticipo rispetto a ciascun trimestre solare durante il Periodo. L’Acquirente dovrà pagare tutti gli importi indiscussi (in buona fede) il primo (I°) Giorno Lavorativo del primo (1s1) mese di ogni trimestre di calendario per il Lotto di Dosi Contrattuali da consegnare in tale trimestre di calendario, o nel caso di Lotto 1, entro cinque (5) Giorni Lavorativi dal rilascio dell’Approvazione Condizionata. Tutti tali importi saranno dovuti prima della consegna del volume delle dosi previste da consegnare
Pagina 14 di 46
tale consegna, il cui Prezzo di consegna sarà pari alla differenza del Prezzo per il numero di Dosi contrattate consegnate in tale consegna e una ripartizione del Pagamento anticipato in base al numero di Dosi contrattate in tale consegna. Il pagamento completo di ciascuna spedizione precedente è una condizione per l’obbligo di Pfizer di fornire qualsiasi spedizione futura. Se l’eventuale mancato pagamento da parte dell’Acquirente di Pfizer per le Dosi Contrattuali comporta un ritardo nella consegna, le dosi non consegnate saranno ad esclusivo rischio dell’Acquirente e Pfizer non avrà alcuna responsabilità nei confronti dell’Acquirente in merito a tale ritardo o ulteriore incapacità di fornitura da parte di Pfizer.
(c) Le fatture saranno fornite all’Acquirente all’indirizzo indicato nel preambolo del presente Contratto. Pfizer includerà le seguenti informazioni su tutte le fatture: il numero dell’Ordine di Acquisto e l’indirizzo di fatturazione; e dovrà includere anche, ove applicabile, la descrizione del tipo, il codice articolo (se presente) e il numero di dosi contrattualmente consegnate; la data di consegna; la data effettiva di spedizione; il prezzo; eventuali tasse applicabili o altri oneri previsti nell’Ordine di Acquisto; e la nave a destinazione.
3.3 Modalità di pagamento.
(a) Gli importi dovuti ai sensi del presente Contratto saranno pagati dall’Acquirente a Pfizer in conformità con le disposizioni della Sezione 3.2(a) e 3.2(b). Il pagamento dovrà essere effettuato tramite bonifico bancario in fondi immediatamente disponibili sul conto bancario Pfizer indicato di seguito. Qualsiasi pagamento dovuto in una data che non sia un Giorno Lavorativo potrà essere effettuato il Giorno Lavorativo successivo. Qualsiasi contestazione da parte dell’Acquirente di una fattura dovrà essere fornita a Pfizer per iscritto (insieme alla documentazione motivante e a una descrizione ragionevolmente dettagliata della controversia) entro cinque (5) giorni lavorativi dalla data di tale fattura. Si riterrà che l’Acquirente abbia accettato tutte le fatture per le quali Pfizer non riceve tempestiva notifica delle controversie e dovrà pagare tutti gli importi non contestati dovuti in base a tali fatture entro il periodo stabilito nella presente Sezione 3.3(a). Le Parti cercheranno di risolvere tutte tali controversie rapidamente e in buona fede.
BANCA: FILIALE:
NUMERO DI FILIALE: VALUTA: NUMERO DI CONTO: SWIFTCODE:
Citibank Johannesburg 350005
ZAR
CITTÀJX
Redatto da HJI il 4 settembre 2023
(b) Qualsiasi importo richiesto da una Parte ai sensi del presente documento che non viene pagato alla data dovuta produrrà interessi, nella misura consentita dalla legge, al cinque per cento (5%) sopra il tasso Repo della South African Reserve Bank (o qualsiasi successore a tale tasso) in vigore dalla data in cui tale pagamento era dovuto, come riportato nel Wall Street Journal (https://www.wsj.com/rnarket-data/bonds). Tali interessi saranno calcolati sulla base di un anno di trecentosessanta (360) giorni per il numero effettivo di giorni di mancato pagamento. [In aggiunta a tutti gli altri rimedi disponibili ai sensi del presente
Pagina 15 di 46
Contratto o per legge, se l’Acquirente non paga eventuali importi non contestati dovuti ai sensi del presente Contratto, Pfizer può (i) sospendere la consegna del Prodotto o (ii) risolvere il presente Contratto.
(e) L’Acquirente non potrà, e riconosce che non avrà alcun diritto, ai sensi del presente Contratto, di qualsiasi Ordine di acquisto, qualsiasi altro accordo, documento o Legge, di trattenere, compensare, recuperare o addebitare eventuali importi dovuti (o divenire esigibili e dovuti ) a Pfizer, ai sensi del presente Contratto o in altro modo, a fronte di qualsiasi altro importo dovuto (o divenuto dovuto e dovuto) nei suoi confronti da Pfizer o da una Affiliata Pfizer.
3.4 Resta inteso e convenuto tra le Parti che tutti i pagamenti effettuati e altri corrispettivi forniti ai sensi del presente Contratto sono al netto di qualsiasi IVA o imposta simile e di tutte le altre imposte sostenute come risultato della produzione e della fornitura del Prodotto (incluse, senza limitazione, imposte doganali dazi, prelievi e oneri e tutte le tasse locali) (“Imposte”), che saranno aggiunte a seconda dei casi. Laddove le Imposte siano adeguatamente addebitabili su un pagamento effettuato o un corrispettivo previsto ai sensi del presente Contratto, la Parte che effettua il pagamento o fornisce il corrispettivo pagherà l’importo delle Imposte in conformità con le leggi e i regolamenti del Paese in cui le Imposte sono addebitabili.
Nel caso in cui i pagamenti effettuati ai sensi del presente Contratto diventino soggetti a ritenute fiscali ai sensi delle leggi o dei regolamenti di qualsiasi giurisdizione, la Parte che effettua tale pagamento dedurrà e tratterrà l’importo di tali imposte per conto del beneficiario nella misura richiesta dalla Legge e tali importi dovuti al beneficiario saranno ridotti dell’importo delle imposte detratte e trattenute. Qualsiasi ritenuta d’acconto richiesta ai sensi della Legge da pagare o trattenuta sarà una spesa a carico, e a carico esclusivo, del beneficiario.
4. STANDARD DI PRODUZIONE E GARANZIA DI OUALITÀ.
4.1 Standard di produzione.
Pfizer produrrà e fornirà il Prodotto in conformità materiale alle Specifiche e alle cGMP. Tali Specifiche potranno essere riviste mediante notifica scritta da parte di Pfizer all’Acquirente per conformarsi all’Autorizzazione o a modifiche nella produzione o distribuzione del Prodotto.
4.2 Documenti e richieste legali e regolamentari.
(a) Pfizer dovrà (a) rispettare tutte le licenze e i permessi normativi o governativi, e
(b) rispettare tutte le cGMP in relazione ai processi di produzione e imballaggio, alle Strutture o altro, per consentire l’adempimento dei propri obblighi di seguito.
(b) Pfizer garantirà che tutti i Prodotti siano adeguatamente etichettati e imballati in conformità con l’Autorizzazione, le Specifiche e gli standard cGMP applicabili.
Pagina 16
(e) Prima della consegna, Pfizer dovrà rispettare tutte le condizioni (nelle relative tempistiche) indicate nell’Autorizzazione; a condizione, tuttavia, che l’Acquirente conceda, o ottenga per conto di Pfizer, tutte le deroghe, eccezioni e deroghe ai requisiti specifici del Paese per il Prodotto concessi o consentiti dall’autorità governativa (inclusi, ma non limitati a, serializzazione, test di laboratorio o di qualità applicabili e /o informazioni di marketing per la presentazione e l’approvazione), i quali requisiti, in assenza di esenzione, eccezione o rinuncia, impedirebbero a Pfizer di fornire e commercializzare il Prodotto in Sud Africa al ricevimento dell’Autorizzazione. L’Acquirente riconosce che il Prodotto verrà fornito senza serializzazione. L’Acquirente si impegna a fare del proprio meglio per indurre le autorità governative competenti a facilitare il rilascio di adeguate deroghe e/o approvazioni in caso di serializzazione attiva, track & trace e/o mandati di codifica 2D entro 24 ore. Al fine di mantenere una catena di fornitura efficiente per la produzione, il rilascio e la fornitura del Prodotto, Pfizer sarà l’unica responsabile della determinazione dei luoghi di produzione e di test e condurrà i test in conformità con l’Autorizzazione. Le Parti hanno concordato che Pfizer non sarà tenuta a rispondere o a fornire il trasferimento di Prodotti o metodi in relazione a richieste di test in loco, richieste di protocolli di rilascio dei lotti o richieste di registrazione di campioni nel presente Contratto o in successivi armendi o estensioni del presente Accordo.
(d) A causa dell’attuale situazione pandemica e del fatto che qualsiasi Autorizzazione anticipata sarà inizialmente soggetta ad Approvazione Condizionata insieme all’accordo secondo cui Pfizer fornirà solo direttamente all’Acquirente, l’Acquirente accetta le seguenti condizioni come condizione sospensiva per la fornitura del prodotto. L’Acquirente rilascerà, o farà rilasciare a qualsiasi altra autorità governativa, tutte le approvazioni necessarie per garantire l’applicabilità delle stesse:
1. Nel corso della Durata, Pfizer non sarà tenuto dall’Acquirente o da qualsiasi altra autorità governativa a nominare un agente locale o un distributore, anche senza limitazioni, allo scopo di vendere o fornire il Prodotto o richiedere l’Autorizzazione, a meno che Pfizer, a sua discrezione durante il Periodo, nomina un agente o distributore locale. A scanso di equivoci, l’Acquirente concorda inoltre che a partire dalla Data di entrata in vigore (I) Pfizer o una delle sue Affiliate sarà l’entità che applicherà e presenterà tutti i documenti normativi richiesti per il rilascio dell’Approvazione condizionale; e (2) l’Approvazione Condizionata sarà rilasciata a nome di Pfizer o di una delle sue Affiliate.
11. Durante il Termine, l’Acquirente o qualsiasi altra autorità governativa non richiederà a Pfizer di presentare un certificato di riferimento del prezzo allo scopo di richiedere l’Approvazione Condizionata o altro.
111. Nel caso in cui durante il Periodo una terza parte sia il richiedente o il titolare dell’Autorizzazione, qualsiasi obbligo imposto a Pfizer ai sensi del presente Contratto sarà considerato come un obbligo per Pfizer di compiere sforzi commercialmente ragionevoli per garantire la conformità di tale autorizzazione di terza parte. richiedente o
Pagina 17 di 46
titolare con tali obblighi nella misura necessaria a garantire che l’obbligo pertinente sia pienamente rispettato.
4.3 Test e controlli di qualità.
Pfizer eseguirà tutti i test di stabilità di conservazione sfusa, prove di produzione, validazione (incluse, ma non limitate a, convalida di metodi, processi e pulizia delle apparecchiature), materie prime, processi, prodotti finiti sfusi e test o controlli di stabilità (chimica o microbica) richiesti per assicurare la qualità del Prodotto e i test o controlli richiesti dalle Specifiche e dalle cGMP.
4.4 Rifiuto del Prodotto; Smaltimento delle spedizioni rifiutate.
(a) L’Acquirente può rifiutare qualsiasi Prodotto che non sia materialmente conforme alle Specifiche o alle cGMP (“Prodotto non conforme”) fornendo comunicazione scritta di rifiuto a Pfizer e indicando le ragioni dettagliate di tale rifiuto: (i) immediatamente (e in nessun caso (evento superiore a 24 ore) alla consegna del Prodotto Non Conforme all’Acquirente; o (ii) immediatamente e in nessun caso oltre 24 ore dalla prima conoscenza di un Difetto Nascosto. Pfizer risponderà tempestivamente a qualsiasi rifiuto e notifica di Prodotto non conforme da parte dell’Acquirente. Per chiarezza, l’Acquirente non avrà il diritto di rifiutare qualsiasi Prodotto sulla base di reclami di servizio a meno che un Prodotto non sia materialmente conforme alle Specifiche o alle cGMP.
(b) Pfizer condurrà un’analisi delle cause di qualsiasi reclamo relativo alla qualità e riferirà all’Acquirente su qualsiasi azione correttiva intrapresa. Se l’ispezione e i test di Pfizer rivelano, con ragionevole soddisfazione di Pfizer, che tali elementi del Prodotto sono Prodotti Non Conformi e che tale conformità o difetto 11011 non è stato causato o contribuito da alcun abuso, uso improprio, negligenza, negligenza, incidente , test impropri, conservazione impropria, manipolazione, stress fisico anomalo, condizioni ambientali anomale o utilizzo contrario alle istruzioni emesse da Pfizer, Pfizer dovrà compiere sforzi commercialmente ragionevoli per sostituire tale Prodotto non conforme non appena possibile senza alcun costo aggiuntivo per l’Acquirente. In tali circostanze, Pfizer organizzerà inoltre la logistica inversa per il ritiro del Prodotto e gestirà la distruzione del Prodotto Non Conforme. Fino! ritiro, l’Acquirente dovrà conservare e conservare il relativo Prodotto Non Conforme in luoghi adeguatamente sicuri e in conformità con le specifiche del produttore. Nonostante qualsiasi altra disposizione del presente Contratto, la presente Sezione 4.4(b) contiene l’unico ed esclusivo rimedio dell’Acquirente per il Prodotto non conforme. Le disposizioni della presente Sezione 4.4 (Rifiuto del Prodotto; Smaltimento delle Spedizioni rifiutate) sopravvivranno alla risoluzione o alla scadenza del presente Contratto.
4.5 Manutenzione e conservazione dei registri.
(a) · Ciascuna Società dovrà conservare registrazioni dettagliate relative alle proprie attività ai sensi del presente Contratto come richiesto dalle Leggi.
(b) L’Acquirente manterrà un sistema di qualità per la ricezione, l’ispezione, lo stoccaggio, la tracciabilità verso ulteriori punti di consegna e le attività di riconsegna. ]f L’Acquirente
Pagina 18 di 46
dispongono di un sistema di qualità per le attività definite, Pfizer può condividere i dettagli di un sistema di qualità proposto per la conformità dell’Acquirente.
4.6 Problemi di diversione.
Il Prodotto Ali consegnato all’Acquirente dovrà essere: (a) conservato in modo sicuro dall’Acquirente; e (b) distribuito dall’Acquirente solo in Sud Africa in modo sicuro e adeguato al percorso di trasporto e alla destinazione, in ciascun caso (a) e (b) per prevenire e scoraggiare furti, deviazioni, manomissioni, sostituzioni (con, ad esempio, , contraffazioni) rivendita o esportazione fuori dal Sud Africa e per proteggere e preservare l’integrità e l’efficacia del Prodotto. L’Acquirente dovrà tempestivamente informare Pfizer Quality Department Product ComplaintsZAF@pfizer.com e Pfizer Adverse Events Reporting tramite e-mail ZAF.AEReporting@pfizer.com entro quarantotto (48) ore (con follow-up per iscritto in linea con le disposizioni di notifica del presente Contratto) se in qualsiasi momento l’Acquirente ritenga che uno qualsiasi dei Prodotti sia stato rubato, deviato, manomesso, sostituito o altrimenti sottoposto ad abuso, uso improprio, negligenza, negligenza, incidente, test impropri,
,,,–._ stoccaggio, manipolazione impropria, stress fisico anomalo, condizioni ambientali anomale
o utilizzarli contrariamente alle istruzioni impartite da Pfizer. L’avviso fornirà tutte le informazioni relative alla diversione del Prodotto, comprese, ma non limitate a, informazioni dettagliate tra cui data, ora, luogo, numero, numero(i) di lotto, data di scadenza, circostanze e informazioni sulla persona(e) di contatto. L’Acquirente dovrà collaborare con Pfizer o con il suo incaricato, su richiesta di Pfizer, per cooperare in relazione a tale diversione del Prodotto. L’Acquirente non potrà direttamente o indirettamente rivendere, esportare, trasferire, donare o distribuire in altro modo il Prodotto al di fuori del Territorio senza il previo consenso scritto di Pfizer.
4.7 Richiami.
5.
5.1
L’Acquirente sarà responsabile di tutti i costi di qualsiasi rivendita o ritiro dal mercato del Prodotto in Sud Africa, inclusi, senza limitazione, i costi ragionevoli sostenuti da o per conto di Pfizer e delle sue affiliate o di BioNTech e delle sue affiliate, salvo nella misura in cui tale ricalibrazione o il ritiro dal mercato deriva da una condotta dolosa (essendo un atto illecito, commesso volontariamente e consapevolmente senza giustificazione legale o fattuale, con l’intento di causare effetti dannosi) da parte di Pfizer o di una delle sue Affiliate o di qualsiasi rispettivo Personale, in tal caso Pfizer sarà responsabile esclusivamente di: (a) eventuali spese vive ragionevoli e documentate direttamente sostenute dall’Acquirente nei confronti di terzi nell’attuazione di tale ritiro o ritiro dal mercato; e (b) sostituire, a spese di Pfizer, il Prodotto da ritirare.
RAPPRESENTAZIONI E GARANZIE.
Dichiarazioni e garanzie reciproche. Pfizer e l’Acquirente dichiarano e garantiscono reciprocamente quanto segue:
(a) Organizzazione e autorità. Ha pieno diritto, potere e autorità di stipulare il presente Contratto e di adempiere ai rispettivi obblighi ai sensi del presente Contratto, incluso, nel caso dell’Acquirente, che tutte le autorizzazioni e approvazioni necessarie siano state ottenute dall’Acquirente per autorizzare l’esecuzione di tutte le sue
Pagina 19 di 46
obblighi qui contenuti, che l’Acquirente ha l’autorità di vincolare la Repubblica del Sud Africa e che l’Acquirente ha esercitato tale autorità per vincolare la Repubblica del Sud Africa in relazione a ciascuna delle disposizioni, dei termini e delle condizioni stabiliti nel presente Contratto;
(b) Nessun conflitto o violazione. L’esecuzione e la consegna del presente Contratto da parte di tale Parte e l’adempimento degli obblighi di tale Parte ai sensi del presente documento (i) non sono in conflitto o violano alcuna legge esistente alla Data di entrata in vigore e applicabile a tale Parte e (ii) non entrare in conflitto, violare, trasgredire o costituire un inadempimento ai sensi di, e non essere proibito o materialmente limitato da, eventuali obblighi contrattuali di tale Parte esistenti alla Data di Efficacia; E
(c) Esecuzione valida. Tale Parte è debitamente autorizzata a eseguire e consegnare il presente Contratto e la Persona che esegue il presente Contratto per conto di tale Parte è debitamente autorizzata a eseguire e vincolare tale Parte ai termini stabiliti nel presente documento.
5.2 Garanzie di Pfizer.
Pfizer garantisce all’Acquirente che:
(a) Al momento della consegna, il Prodotto (ad eccezione di qualsiasi non conformità o mancato rispetto degli standard o dei requisiti pertinenti che non poteva essere ragionevolmente scoperto considerato lo stato delle conoscenze mediche, scientifiche o tecniche al momento in cui Pfizer ha consegnato il Prodotto) Prodotto):
(i) è conforme in modo sostanziale alle Specifiche pertinenti; E
(ii) è stato prodotto in conformità con le attuali buone pratiche di fabbricazione.
(b) Fatta salva la clausola di non violazione dei diritti di proprietà intellettuale di terzi da parte di Pfizer (di cui alla Sezione 5.4(a) e (b) di seguito), Pfizer ha un buon titolo sul Prodotto consegnato all’Acquirente ai sensi del presente Contratto e trasferirà tale titolo all’Acquirente libero e libero da eventuali interessi di garanzia, privilegi o altri gravami.
(e) L’esecuzione, la consegna e l’esecuzione del presente Contratto da parte di Pfizer non violeranno alcun accordo o strumento di cui Pfizer è parte.
5.3 Anti-concussione/anticorruzione e controlli sul commercio globale.
(a) Le Parti dichiarano e garantiscono che, al di là del reciproco corrispettivo stabilito nel presente Contratto, né loro né i loro agenti hanno fornito o richiesto, o forniranno o richiederanno, alcun ulteriore incentivo o vantaggio a o dall’altra Parte o
i suoi agenti per indurre una delle Parti a stipulare il presente Contratto o ad eseguire qualsiasi parte del presente Contratto. ·
(b) Pfizer non ha effettuato, e non effettuerà, in esecuzione del presente Contratto, direttamente o indirettamente, alcun pagamento, offerta, promessa o autorizzazione di pagamento di denaro o qualsiasi cosa di valore a un funzionario governativo, partito, candidato per
Pagina 20 di 46
carica politica, o qualsiasi altra Persona, e non ha cercato e non cercherà di influenzare in modo improprio o corrotto alcun funzionario governativo, candidato alla politica, ufficio, o qualsiasi altra Persona, al fine di ottenere un vantaggio commerciale improprio.
(c) Le Parti rispetteranno le sanzioni economiche applicabili, le leggi, i regolamenti e gli ordini sul controllo delle importazioni e delle esportazioni nell’esecuzione del presente Accordo.
(d) Le attività svolte ai sensi del presente Accordo non coinvolgeranno le Parti soggette a restrizioni (definite come l’elenco delle parti sanzionate gestito dalle Nazioni Unite; l’Elenco dei cittadini appositamente designati e l’Elenco delle identificazioni delle sanzioni settoriali, come amministrato dal Dipartimento del Tesoro degli Stati Uniti). Foreign Assets Contro!; la U.S. Denied Persons List, la U.S. Entity List e la U.S. Unverified List, tutte gestite dal Dipartimento del Commercio degli Stati Uniti; le entità soggette a misure restrittive e la Consolidated List of Persons, Groups and Entities soggette all’U.E. sanzioni finanziarie, come attuate dalla politica estera e di sicurezza comune dell’UE; ed elenchi simili di soggetti soggetti a restrizioni gestiti da enti governativi pertinenti).
(e) Nonostante qualsiasi altra disposizione del presente Contratto, Pfizer non sarà tenuta a intraprendere o astenersi dall’intraprendere qualsiasi azione vietata o sanzionata dalle leggi degli Stati Uniti o da qualsiasi giurisdizione non statunitense applicabile, comprese, a titolo esemplificativo, le leggi antiboicottaggio amministrato dai dipartimenti del Commercio e del Tesoro degli Stati Uniti.
5.4 Nessuna altra garanzia.
Fatta eccezione per quanto espressamente stabilito nel presente Contratto, tutte le condizioni, garanzie o altri termini che potrebbero avere effetto tra le Parti o essere impliciti o incorporati nel presente Contratto (per statuto, diritto comune o altro) sono esclusi nella misura massima consentito dalle leggi. Fatta salva la natura generale della frase precedente, a meno che il presente Contratto non disponga diversamente e nella misura massima consentita dalla legge, Pfizer declina espressamente qualsiasi dichiarazione o garanzia in relazione al Prodotto, incluse, ma non limitate a, qualsiasi dichiarazione, garanzia o impegno riguardo a (a) non violazione dei diritti di proprietà intellettuale di terzi, (b) che non è necessario ottenere una licenza di diritti di proprietà intellettuale di terzi per consentire l’uso o la ricezione del Prodotto, (e) commerciabilità, o (d) idoneità per uno scopo particolare.
5.5 Conferma dell’Acquirente.
L’Acquirente riconosce che il vaccino e i materiali ad esso relativi, nonché i relativi componenti e materiali costitutivi sono in fase di rapido sviluppo a causa delle circostanze di emergenza della pandemia di COVID-19 e continueranno a essere studiati dopo la fornitura del vaccino all’Acquirente ai sensi del presente Contratto. L’Acquirente riconosce inoltre che gli effetti e l’efficacia a lungo termine del vaccino non sono attualmente noti e che potrebbero esserci effetti avversi del vaccino attualmente non noti. Inoltre, nella misura applicabile, l’Acquirente riconosce che il Prodotto non sarà serializzato.
Pagina 21 di 46
6. TERMINE; FINE.
6.1 Durata del contratto.
Il presente Contratto avrà inizio alla Data di entrata in vigore e continuerà fino alla data successiva
(a) consegna delle dosi contrattualmente previste del Prodotto ai sensi dell’Ordine di acquisto accettato presentato alla Data di efficacia e (b) ventiquattro (24) mesi dalla Data di efficacia, salvo proroga o risoluzione ai sensi della presente Sezione 6 (Durata; Risoluzione) o il mutuo accordo scritto tra le Parti (“Durata”).
6.2 Risoluzione per giusta causa.
Ciascuna Parte può risolvere il presente Contratto immediatamente previa comunicazione scritta all’altra Parte in caso di violazione materiale da parte dell’altra Parte di qualsiasi termine del presente Contratto, violazione che rimane non sanata per trenta (30) giorni successivi alla notifica scritta all’altra Parte di tale violazione materiale. Nonostante quanto sopra, se tale violazione materiale, per sua natura, non può essere sanata, la Parte recedente potrà risolvere il presente Contratto immediatamente previa comunicazione scritta all’altra Parte. Nel caso in cui il presente Contratto venga risolto da Pfizer ai sensi della presente Sezione 6.2, l’Acquirente dovrà pagare entro trenta (30) giorni dalla data di notifica della risoluzione del presente Contratto l’intero Prezzo per le Dosi Contrattate meno gli importi già pagati a Pfizer a tale data. .
6.3 Diritti di risoluzione reciproci.
(a) Nel caso: (i) l’Autorizzazione non sia stata ottenuta nel Territorio da
30 settembre 2021 (tranne nel caso in cui tale evento sia principalmente o esclusivamente attribuibile all’Acquirente o a qualsiasi ministero o segretario del governo della Repubblica del Sud Africa) Pfizer non ha fornito all’Acquirente alcuna dose di Prodotto entro il 30 settembre 2021, soggetto al proroghe stabilite nella Sezione 2.4 (Programma di consegna), o (ii) Pfizer non è in grado di fornire tutte le dosi contrattate entro il 31 dicembre 2022, ciascuna delle Parti potrà risolvere il presente Contratto previa comunicazione scritta all’altra Parte. L’Acquirente può fatturare a Pfizer un rimborso del cinquanta per cento (50%) del pagamento anticipato per le dosi contrattualmente non consegnate (come determinato proporzionalmente per le dosi non consegnate) ad eccezione dei casi in cui la causa della risoluzione è principalmente o esclusivamente attribuibile all’Acquirente. Nel caso in cui il presente Contratto venga risolto ai sensi della presente Sezione 6.3, la restituzione del cinquanta per cento (50%) del pagamento anticipato costituirà l’unico ed esclusivo rimedio dell’Acquirente per la mancata consegna delle Dosi contratte.
6.4 Risoluzione in caso di insolvenza.
Nel caso in cui Pfizer: (a) diventi insolvente, o istituisca o abbia avviato nei suoi confronti istanza di fallimento o venga dichiarata fallita; o (b) esegue un atto di vendita, un atto fiduciario o una cessione generale a beneficio dei creditori; o (c) viene sciolto o trasferisce una parte sostanziale del proprio patrimonio a terzi (escluse le Affiliate di Pfizer); o (d) ha nominato un curatore fallimentare a beneficio dei suoi creditori, o ha nominato un curatore fallimentare a causa di insolvenza; allora Pfizer informerà immediatamente l’Acquirente di tale evento e l’Acquirente avrà il diritto di risolvere il presente Contratto.
Pagina 22 di 46
6.5 Effetto della risoluzione.
(a) Alla scadenza o alla risoluzione del presente Contratto per qualsiasi motivo:
(i) L’Acquirente dovrà pagare qualsiasi somma dovuta a Pfizer ai sensi del presente Contratto entro trenta (30) giorni dalla data della fattura della stessa; E
(ii) ciascuna Parte dovrà utilizzare sforzi commercialmente ragionevoli per mitigare sia (1) i danni che sarebbero altrimenti recuperabili dall’altra ai sensi del presente Contratto, sia (2) eventuali costi, commissioni, spese o perdite che potrebbero essere sostenute da una Parte , o per i quali una Parte può essere responsabile, ai sensi del presente Contratto, adottando azioni appropriate e ragionevoli per ridurre o limitare l’importo di tali danni, costi, commissioni, spese o perdite.
(b) La risoluzione o la scadenza del presente Contratto non pregiudicherà la sopravvivenza e la validità continua delle Sezioni I, 2.l(b)-(d), 2.5(b), 2.6, 2.7(b)-(e), 2.8 , 3.1, 3.3,
3.4, 4.4, 4.5, 4.6, 4.7, 5.4, 5.5, 6.2 (frase finale), 6.5, 7, 8, 9.2, 9.3, 9.4, 9.5, 9.6,
lO, 11, 12 o di qualsiasi altra disposizione che sia espressamente o implicitamente destinata a restare in vigore dopo tale cessazione o scadenza.
(e) La scadenza o la risoluzione del presente Contratto per qualsiasi motivo non pregiudicherà gli altri diritti e rimedi di ciascuna delle Parti o eventuali diritti e responsabilità maturati alla data di tale scadenza o risoluzione; a condizione che (i) Pfizer non avrà alcuna responsabilità per l’eventuale mancato sviluppo o ottenimento dell’autorizzazione del Prodotto da parte di Pfizer in conformità con le date stimate descritte nel presente Contratto e (ii) anche se il Prodotto viene sviluppato con successo e Pfizer ottiene l’autorizzazione, Pfizer non avrà alcuna responsabilità per l’eventuale mancata consegna delle dosi contrattate in conformità con le date di consegna stimate stabilite nel presente documento.
7. PROPRIETÀ INTELLETTUALE.
Pfizer US sarà l’unico proprietario di tutta la proprietà intellettuale generata durante lo sviluppo, la produzione e la fornitura del Prodotto o altrimenti correlata al Prodotto. Nessuna delle Parti acquisirà alcun diritto di proprietà o utilizzo di qualsiasi proprietà o Proprietà intellettuale posseduta dall’altra (in virtù del presente Contratto, implicitamente o in altro modo).
8. INDENNIZZO.
8.1 Indennizzo da parte dell’Acquirente. L’Acquirente si impegna a indennizzare, difendere e tenere indenne Pfizer, BioNTech, ciascuna delle loro affiliate, appaltatori, subappaltatori, licenziatari, licenziatari, sublicenziatari, distributori, produttori a contratto, fornitori di servizi, ricercatori di sperimentazioni cliniche, terze parti a cui Pfizer o BioNTech o una qualsiasi delle loro rispettive Affiliate può direttamente o indirettamente dover un’indennità basata sulla ricerca, sviluppo, produzione, distribuzione, commercializzazione o utilizzo del vaccino, e ciascuno dei funzionari, direttori, dipendenti e altri agenti e rappresentanti, e i rispettivi predecessori, successori e cessionari di uno qualsiasi dei suddetti (“indennizzati”), da e contro qualsiasi causa, rivendicazione, azione, richiesta, perdita, danno, responsabilità, transazione,
Pagina 23 di 46
sanzioni, multe, costi e spese (incluse, senza limitazioni, ragionevoli onorari di avvocati e altri consulenti legali e altre spese di un’indagine o di un contenzioso), siano essi derivanti da contratto, illecito civile (delitto), proprietà intellettuale o qualsiasi altra teoria, e siano essi legali, statutari, equitativi o altrimenti da qualsiasi persona fisica o giuridica (collettivamente, “Perdite”) causate da, derivanti da, relative o risultanti dal vaccino, inclusa ma non limitata a qualsiasi fase di progettazione, sviluppo, indagine , formulazione, test, clinica! test, produzione, etichettatura, imballaggio, trasporto, conservazione, distribuzione, marketing, promozione, vendita, acquisto, · concessione di licenza, donazione, dispensazione, prescrizione, somministrazione, fornitura o utilizzo del vaccino, qualsiasi informazione, istruzione, consiglio o orientamento fornito da Pfizer, o BioNTech o da una delle rispettive Affiliate e in relazione all’uso del vaccino o a qualsiasi elaborazione o trasferimento della personalità di chiunque! informazioni elaborate e trasferite dall’Acquirente agli Indennizzati (“Attività coperte”).
8.2 Assunzione della difesa da parte dell’Acquirente. Il Risarcitario dovrà notificare all’Acquirente le Perdite per le quali richiede il risarcimento ai sensi del presente (“Reclami indennizzati”). A seguito di tale notifica, il/i beneficiario/i avranno la possibilità di condurre e controllare! la difesa o richiedere all’Acquirente di assumere tempestivamente la condotta e il controllo della difesa di tali Richieste di indennizzo con un legale accettabile per gli Indennizzati, indipendentemente dal fatto che la Richiesta di indennizzo sia legittimamente avanzata o meno; a condizione, tuttavia, che l’Acquirente fornisca un preavviso scritto di qualsiasi proposta di compromesso o di soluzione di qualsiasi Reclamo indennizzato e in nessun caso l’Acquirente possa compromettere o risolvere qualsiasi Reclamo indennizzato senza
Il previo consenso scritto del/i beneficiario/i, tale consenso non potrà essere irragionevolmente negato. Gli indennizzati dovranno ragionevolmente collaborare con l’Acquirente nella difesa di qualsiasi Richiesta di indennizzo condotta e controllata dall’Acquirente.
8.3 Diritti di partecipazione. Ciascun Indennizzato avrà il diritto di avvalersi del proprio legale e di partecipare alla difesa dell’Acquirente da qualsiasi Reclamo indennizzato, a proprie spese e spese, ad eccezione di quanto indicato di seguito. La mancata comunicazione da parte del/dei Beneficiario/i di pretese di indennizzo o di offerta di difendere l’azione o causa ai sensi della presente Sezione 8.3 (Diritti di partecipazione) non limiterà l’obbligo dell’Acquirente ai sensi della presente Sezione 8 (Risarcimento), salvo e solo nella misura in cui l’Acquirente ne sia effettivamente pregiudicato.
8.4 Assunzione di difesa. Nonostante quanto sopra e senza pregiudizio della Sezione 12.5, Pfizer, direttamente o tramite una delle sue Affiliate o tramite BioNTech, può scegliere di assumere il controllo! della difesa di una Richiesta di indennizzo (a) entro trenta (30) giorni dalla comunicazione del Risarcitore all’Acquirente della Richiesta di indennizzo o (b) in qualsiasi momento se, a esclusiva discrezione di Pfizer: (i) L’Acquirente non assume tempestivamente la difesa di o difendere ragionevolmente tale(i) Richiesta(i) di indennizzo(i) in buona fede in modo soddisfacente per Pfizer (o le Affiliate di Pfizer e BioNTech); o (ii) Pfizer ritiene (o una qualsiasi delle sue affiliate o BioNTech ritiene) in buona fede che esista un conflitto in buona fede tra il/i beneficiario/i e l’Acquirente rispetto a una richiesta di indennizzo ai sensi del presente documento. Previa comunicazione scritta di tale scelta, Pfizer avrà il diritto di assumere il controllo! di tale difesa (direttamente o tramite una delle sue Affiliate o BioNTech), e l’Acquirente dovrà pagare (come sostenuto e su richiesta), tutte le perdite, comprese, senza limitazioni, le ragionevoli spese legali e altre spese sostenute dal/i Beneficiario/i , in relazione alla richiesta di indennizzo. In ogni caso, l’Acquirente dovrà collaborare con il/i contraente/i nella difesa, nella transazione o nel compromesso del contratto e Richiesta di indennizzo.
Pagina 24 di 46
Privilegi e immunità. L’Acquirente riconosce che i suoi obblighi di indennizzo ai sensi del presente Contratto sono (a) espressamente in aggiunta a, e non limitati da, eventuali Privilegi e immunità e (b) non rinunciano o rinunciano ai diritti degli Indennizzati su alcun Privilegio e immunità.
Costi. I costi e le spese, inclusi, a titolo esemplificativo, onorari ed esborsi legali, sostenuti dal/i beneficiario/i in relazione a qualsiasi richiesta di risarcimento saranno rimborsati su base trimestrale dall’Acquirente, fatto salvo il diritto di rimborso dell’Acquirente nel caso in cui l’Acquirente viene infine ritenuto in una sentenza o in un lodo definitivo e appellabile 11011 non essere obbligato a risarcire il/i beneficiario/i.
9. ASSICURAZIONE E RESPONSABILITÀ.
9.1 Assicurazione.
Nel corso della Durata, Pfizer o le sue affiliate dovranno autoassicurarsi o procurarsi e mantenere tali tipi e importi di assicurazione di responsabilità civile generale per coprire le passività relative alle proprie attività ai sensi del presente Contratto come è normale e consuetudine nel settore farmaceutico in generale per le aziende che si trovano in una situazione simile e fornire servizi di produzione e fornitura simili. Per assoluta chiarezza, ciò non includerà, né costituirà, un’assicurazione di responsabilità del prodotto a copertura di eventuali pretese di terzi/pazienti e tale assicurazione di responsabilità generale non pregiudicherà l’obbligo di indennizzo dell’Acquirente come stabilito nel presente Contratto.
9.2 Limiti di responsabilità.
(a) Fatte salve le esclusioni stabilite nella Sezione 9.3, in nessuna circostanza (i) ciascuna Parte sarà responsabile nei confronti dell’altra Parte o delle sue Affiliate, sia derivante da illecito civile (inclusa, senza limitazione, negligenza), contratto o altro, per qualsiasi danno indiretto, speciale, consequenziale, incidentale o punitivo, sia in contratto, garanzia, atto illecito, negligenza, responsabilità oggettiva o altrimenti derivante da o relativo al presente Contratto, alle transazioni ivi contemplate o a qualsiasi violazione dello stesso (anche non ragionevolmente prevedibile e anche se la prima Parte fosse stata informata della possibilità che l’altra Parte subisse tale perdita o tipo di perdita) e (ii) nel caso di Pfizer e delle sue Affiliate, in nessun caso Pfizer sarà responsabile nei confronti dell’Acquirente per eventuali danni diretti salvo nella misura in cui tali danni diretti siano il risultato di una violazione materiale di una dichiarazione o garanzia di Pfizer ai sensi del presente Contratto che ha causato direttamente ed esclusivamente il danno. In nessun caso Pfizer e le sue affiliate saranno responsabili nei confronti dell’Acquirente (sia derivanti da garanzia, torto (inclusa, senza limitazione, negligenza), contratto, responsabilità civile o altro) per eventuali responsabilità dell’Acquirente verso terzi, incluse, senza limitazione, tramite contributo, indennizzo o per qualsiasi pretesa per la quale l’Acquirente dovrebbe risarcire Pfizer se tale pretesa fosse portata direttamente contro Pfizer.
(b) La responsabilità complessiva di Pfizer e delle sue affiliate (sia derivante da garanzia, illecito civile (inclusi, senza limitazioni, negligenza, contratto, responsabilità oggettiva o altro) derivante da, ai sensi o in connessione con il presente Contratto non dovrà superare una somma
Pagina 25 di 46
equivalente al cento per cento (I 00%) del Prezzo totale effettivamente ricevuto da Pfizer ai sensi del presente Contratto per le Dosi Contrattate.
9.3 Responsabilità esclusa.
Niente nel presente Contratto esclude o limita la responsabilità di Patty per:
(i) frode o falsa dichiarazione fraudolenta;
(ii) qualsiasi violazione della Sezione IO (Informazioni riservate);
(iii) nel caso dell’Acquirente, l’indennità dallo stesso riconosciuta ai sensi dell’Articolo 8 (Indennizzo); O
(iv) nel caso dell’Acquirente, mancato pagamento del Prezzo del Prodotto o di qualsiasi altra somma dovuta a Pfizer ai sensi del presente Contratto.
9.4 Rinuncia all’immunità sovrana. L’Acquirente, per conto suo e della Repubblica del Sud Africa, rinuncia espressamente e irrevocabilmente a qualsiasi diritto di immunità che lui o i suoi beni potrebbero avere o acquisire in futuro (sia esso caratterizzato come immunità sovrana o qualsiasi altro tipo di immunità), incluso qualsiasi beni controllati da qualsiasi agenzia, ente, banca centrale o autorità monetaria della Repubblica del Sud Africa come specificato dall’articolo 28
U.S.C. § 1611 in relazione a qualsiasi arbitrato ai sensi della Sezione 12.2 (Arbitrato) o qualsiasi altra procedura legale avviata per confermare o applicare qualsiasi decisione, ordine o lodo arbitrale, o qualsiasi accordo in relazione a qualsiasi arbitrato ai sensi della Sezione 12.2 (Arbitrato), sia in Repubblica del Sud Africa o qualsiasi altra giurisdizione straniera, inclusa ma non limitata all’immunità contro la notifica di atti processuali, l’immunità giurisdizionale, l’immunità contro qualsiasi sentenza emessa da una corte o tribunale) (incluso qualsiasi lodo o decisione provvisoria), immunità contro qualsiasi ordine di esecuzione della sentenza e immunità contro il sequestro cautelare di qualsiasi suo patrimonio. L’Acquirente, per conto proprio e della Repubblica del Sud Africa, si impegna inoltre a non far valere tale immunità in qualsiasi procedimento connesso con il presente Accordo. L’Acquirente, per conto suo e della Repubblica del Sud Africa, si sottomette espressamente e irrevocabilmente alla giurisdizione dei tribunali di New York, o qualsiasi altro tribunale della giurisdizione competente, allo scopo di far rispettare qualsiasi decisione arbitrale, ordine o lodo, o qualsiasi transazione in relazione a qualsiasi arbitrato ai sensi della Sezione 12.2 e dichiara e garantisce che la persona che firma il presente Contratto per suo conto ha l’effettiva autorità di sottomettersi a tale giurisdizione. L’Acquirente rinuncia inoltre espressamente e irrevocabilmente all’applicazione di qualsiasi Legge in qualsiasi giurisdizione che potrebbe altrimenti limitare o limitare il suo obbligo di risarcire i danni derivanti da o in connessione con qualsiasi Richiesta di indennizzo. L’Acquirente dichiara e garantisce che la persona che firma il presente Contratto per suo conto ha l’effettiva autorità di rinunciare a tale immunità e vincola l’Acquirente e la Repubblica del Sud Africa alle limitazioni di responsabilità e alle esenzioni di responsabilità qui stabilite.
9.5 Programma di compensazione vaccinale. L’Acquirente si impegna e accetta che, entro e non oltre il 30 aprile 2021, creerà, dedicherà e manterrà un fondo di risarcimento senza colpa sufficiente ad assumere e adempiere completamente agli obblighi di indennizzo previsti dall’Accordo Definitivo (il “Fondo Dedicato”). L’Acquirente dovrà garantire che qualsiasi richiesta di risarcimento per danni, lesioni o danni derivanti da, relativi a o risultanti dallo sviluppo,
Pagina 26 di 46
la somministrazione o l’uso del vaccino nel territorio o fornito ai sensi del presente accordo definitivo – sia che avvenga prima o dopo la creazione del Fondo dedicato – rientreranno nell’ambito del Fondo dedicato e potranno beneficiare di un risarcimento ai sensi del Fondo dedicato.
9.6 Condizioni sospensive alla Fornitura.
(a) L’Acquirente dichiara di avere e continuerà ad avere un’adeguata autorità statutaria o regolamentare e adeguati stanziamenti di finanziamento per intraprendere e adempiere completamente agli obblighi di indennizzo e fornire un’adeguata protezione a Pfizer e a tutti gli Indennizzati dalla responsabilità per sinistri e tutte le perdite derivanti da o in relazione al vaccino o al suo utilizzo.
(b) Con la presente l’Acquirente conviene, riconosce e accetta che le seguenti sono condizioni sospensive alla fornitura del vaccino:
(i) L’Acquirente dovrà implementare e mantenere in vigore tali requisiti statutari o regolamentari o stanziamenti di finanziamento sufficienti a soddisfare i propri obblighi ai sensi del presente Contratto prima della fornitura del Prodotto da parte di Pfizer e successivamente dovrà mantenere tali requisiti statutari e regolamentari e stanziamenti di finanziamento, ciascuno a seconda dei casi , per tutto il tempo necessario a soddisfare tutti gli obblighi dell’Acquirente ai sensi del presente Contratto, inclusi, a titolo esemplificativo, eventuali obblighi che, ai sensi della Sezione 6.5, sopravvivono alla scadenza o alla risoluzione del presente Contratto;
(ii) L’Acquirente dovrà implementare e mantenere il Fondo Dedicato ai sensi della Sezione 9.5 del presente Contratto; E
(iii) L’Acquirente deve dimostrare, in modo soddisfacente per Pfizer, che Pfizer e le sue affiliate avranno una protezione adeguata, come determinato a esclusiva discrezione di Pfizer, dalla responsabilità per reclami derivanti da o in connessione con il vaccino o il suo utilizzo, incluso ma non limitato a, che la Repubblica del Sud Africa continuerà a finanziare il Fondo Dedicato per far fronte a tutti gli obblighi di indennizzo e fornirà come condizione sospensiva alla firma del presente Accordo e alla fornitura delle dosi, la documentazione attestante l’autorizzazione agli obblighi di indennizzo.
(c) Pmchaser riconosce che (a) la fornitura del Prodotto da parte di Pfizer ai sensi del presente fa affidamento (senza alcun obbligo di indagine o conferma da parte o per conto di Pfizer o delle sue affiliate), tra l’altro, sulle dichiarazioni e sugli accordi dell’Acquirente ai sensi della presente Sezione 9.6, l’Acquirente attuando e mantenendo in vigore i requisiti e gli stanziamenti di finanziamento descritti nella presente Sezione 9.6 e le altre dichiarazioni e garanzie rese dall’Acquirente ai sensi del presente Contratto e (b) nel valutare il costo e il prezzo del vaccino ai sensi del presente Contratto, Pfizer ha tenuto conto le suddette tutele di indennizzo e responsabilità e pertanto considerano tale indennizzo e tutela di responsabilità come elementi fondamentali del presente Accordo.
Pagina 27 di 46
(d) A scanso di equivoci, ciascuno dei requisiti di cui alla presente Sezione 9.6 deve essere soddisfatto prima della fornitura o della continuazione della fornitura del vaccino. Il soddisfacimento di tutte tali condizioni sospensive sarà determinato da Pfizer, a sua esclusiva discrezione. Se una qualsiasi condizione sospensiva non è soddisfatta, Pfizer può comunque scegliere di fornire le dosi, a sua esclusiva discrezione. La prestazione parziale di Pfizer ai sensi del presente Contratto, inclusa qualsiasi fornitura facoltativa ai sensi della presente Sezione 9.6(d), non costituirà rinuncia. Se Pfizer determina, a sua esclusiva discrezione, che l’adempimento di qualsiasi condizione ai sensi della presente Sezione 9.6 decade o diventa altrimenti insoddisfacente, allora Pfizer non sarà obbligata a fornire ulteriore vaccino
10. INFORMAZIONI CONFIDENZIALI
10.1 Non utilizzo e non divulgazione.
Ciascun Destinatario dovrà, e dovrà fare in modo che i suoi Rappresentanti che hanno accesso alle Informazioni riservate della Parte divulgante, mantengano la massima riservatezza e non divulghino a terzi, tutte le Informazioni riservate osservate o divulgate ad essa da o per conto della Parte divulgante Parte ai sensi del presente Accordo. Ciascun Destinatario non utilizzerà o divulgherà tali Informazioni riservate salvo quanto consentito dal presente Contratto. Ciascun Destinatario dovrà salvaguardare la natura riservata e proprietaria delle Informazioni riservate della Parte divulgante almeno con lo stesso grado di cura con cui detiene le proprie informazioni riservate o proprietarie di tipo simile, che non sarà inferiore a un livello di cura ragionevole. La Ricevente e i suoi Rappresentanti possono utilizzare, copiare e fare estratti delle Informazioni riservate di Paity Divulgante solo in relazione all’adempimento dei propri obblighi ai sensi del presente Contratto e, senza limitare quanto sopra, non utilizzeranno le Informazioni riservate a beneficio della Ricevente o uno qualsiasi dei suoi Rappresentanti, o a beneficio di qualsiasi altra Persona. Nel caso in cui la Parte ricevente venga a conoscenza di qualsiasi violazione degli obblighi contenuti nella presente Sezione IO (Informazioni riservate) da parte sua o dei suoi Rappresentanti, la Parte ricevente dovrà tempestivamente notificare per iscritto alla Parte divulgante tale violazione e tutti i fatti a conoscenza della Parte ricevente in merito alla stessa. Inoltre, se la Parte ricevente è tenuta a divulgare le Informazioni riservate della Parte divulgante in relazione a qualsiasi ordinanza del tribunale, statuto o direttiva governativa o requisito ai sensi di qualsiasi legge, la Parte ricevente dovrà informare la Parte divulgante di tale richiesta, non appena possibile, prima che tali Informazioni riservate Le informazioni vengono divulgate in modo che la Parte divulgante possa richiedere un provvedimento protettivo appropriato o altro rimedio, o rinunciare al rispetto delle disposizioni pertinenti del presente Contratto. Se la Parte Divulgante richiede un provvedimento protettivo o un altro rimedio, la Parte Ricevente dovrà prontamente cooperare e assistere ragionevolmente la Parte Divulgante (a spese della Parte Divulgante) in tali sforzi. Se la Parte divulgante non riesce a ottenere un mandato di protezione o rinuncia al rispetto delle disposizioni pertinenti del presente Accordo, la Parte ricevente dovrà divulgare solo quella parte delle Informazioni riservate che il suo consulente legale ritiene sia tenuta a divulgare. Né il presente Contratto né l’esecuzione da parte di una delle Parti ai sensi dello stesso trasferiranno alla Parte ricevente alcun diritto di proprietà, titolo, interesse o pretesa su qualsiasi delle Informazioni riservate della Parte divulgante (inclusi, ma non limitati a, eventuali diritti di proprietà intellettuale ivi esistenti) o essere interpretato come concessione di una licenza sulle sue Informazioni riservate. Nonostante quanto sopra, in tutti i casi, (a) l’Acquirente non può rivelare alcuna delle disposizioni finanziarie o di indennizzo contenute nel presente Contratto, incluso, a titolo esemplificativo, il prezzo per dose o Prodotto o il rimborso dell’Anticipo
Pagina 28 di 46
pagato o qualsiasi informazione che possa ragionevolmente accertare il prezzo per dose di Prodotto, senza il previo consenso scritto di Pfizer, e (b) Pfizer può divulgare (i) Informazioni riservate alle sue affiliate e a BioNTech senza previo consenso scritto dell’Acquirente, e
(ii) su richiesta del governo straniero, informazioni finanziarie relative al presente Accordo, compreso il costo per dose.
I0.2 Precauzioni per il destinatario.
Al fine di rispettare gli obblighi contenuti nella presente Sezione IO (Informazioni riservate), la Parte ricevente dovrà adottare almeno le seguenti precauzioni: (a) La Parte ricevente dovrà esercitare tutti gli sforzi ragionevoli per impedire a dipendenti non autorizzati e a soggetti terzi non autorizzati di accedere alle Informazioni riservate ( e in nessun caso meno di una ragionevole diligenza); (b) La Parte ricevente dovrà divulgare le Informazioni riservate solo ai suoi Rappresentanti che hanno necessità di conoscere tali Informazioni riservate per adempiere ai propri obblighi ai sensi del presente Contratto; a condizione, tuttavia, che prima di qualsiasi divulgazione di Informazioni riservate, la Parte ricevente obblighi i suoi Rappresentanti che ricevono tali Informazioni riservate a un accordo scritto di riservatezza almeno altrettanto restrittivo del presente Accordo; e (c) prima di qualsiasi divulgazione, la Parte ricevente dovrà istruire i propri rappresentanti sulla natura riservata delle Informazioni riservate e su come mantenerle riservate. Il Destinatario sarà responsabile delle azioni dei suoi Rappresentanti, inclusa, a titolo esemplificativo, qualsiasi violazione dei termini del presente documento, indipendentemente dal fatto che tali Rappresentanti rimangano o meno dipendenti o in rapporto contrattuale con il Destinatario.
I0.3 Restituzione di informazioni riservate.
Su richiesta scritta della Parte divulgante, la Parte ricevente dovrà prontamente restituire o, a scelta della Parte ricevente, eliminare o distruggere tutte le Informazioni riservate della Parte divulgante (incluse, senza limitazioni, tutte le copie su qualsiasi supporto fornite a, o realizzate da, tale destinatario); a condizione, tuttavia, che, in conformità ai termini del presente Contratto, (i) la Parte ricevente avrà il diritto di conservare una copia di archivio di tali Informazioni riservate allo scopo di determinare i propri obblighi ai sensi del presente Contratto; e (ii) La Parte ricevente non sarà tenuta a distruggere i file informatici archiviati in modo sicuro dai Destinatari o dalle sue Affiliate, creati durante il backup automatico del sistema o conservati per scopi legali dalla divisione legale della Parte ricevente e dalle sue Affiliate, a condizione che tali dati conservati Le informazioni riservate rimarranno soggette ai termini del presente Accordo. Nonostante la restituzione o la distruzione delle Informazioni riservate da parte della Parte ricevente, la Parte ricevente continuerà a essere vincolata al proprio obbligo di riservatezza e non utilizzo ai sensi del presente Contratto.
I0.4 Sopravvivenza.
Le disposizioni della presente Sezione IO (Informazioni riservate) sopravvivranno alla decadenza o alla scadenza del presente Accordo per un periodo di dieci (IO) anni, ad eccezione di qualsiasi informazione che costituisca un segreto commerciale (come definito dalla legge), in cui In questo caso, il destinatario di tali informazioni continuerà a essere vincolato ai propri obblighi ai sensi della presente Sezione 10 (Informazioni riservate) per tutto il tempo in cui tali informazioni continuano a costituire un
segreto commerciale, ma in nessun caso per un periodo inferiore al periodo di dieci (10) anni sopra specificato.
Pagina 29 di 46
11. AVVISI.
Qualsiasi avviso richiesto ai sensi del presente documento dovrà essere in forma scritta e ritenuto sufficientemente fornito, (a) se consegnato di persona, (b) il giorno lavorativo successivo alla spedizione tramite corriere notturno o, laddove il servizio di corriere notturno non sia disponibile , mediante altra consegna rapida fornita da un corriere espresso riconosciuto, o (e) quando consegnato via e-mail, a condizione che l’originale venga consegnato tramite uno dei metodi precedenti entro o prima del quinto (5°) Giorno lavorativo successivo alla trasmissione dell’e -mail, agli indirizzi di seguito specificati. Ciascun avviso dovrà specificare il nome, la data e le parti del presente Contratto.
Se all’Acquirente:
Dr AB Xuma Building 1112 Voortrek:k:er Rd Pretoria Townlands 351-JR Pretoria
0187
Attenzione: Il Direttore Generale
(Alla data di entrata in vigore, essendo: Dr SSS Buthelezi
Con copia (che non costituirà comunicazione) a:
Dr AB Xuma Building 1112 Voortrekker Rd Pretoria Townlands 35 l-JR Pretoria
0187
Attenzione: Direttore, Affordable Medicines
(Alla data di entrata in vigore, essendo: Khadija Jarnaloodien
Se a Pfizer:
Redatto da HJI il 4 settembre 2023
Con copia (che non costituirà comunicazione) a:
Pfizer Laboratories (Pty) Ltd 85 Bute Lane
Sandton Johannesburg Sud Africa 2196
Attenzione: Country Manager
Pfizer Laboratories (Pty) Ltd 85 Bute Lane
Sandton Johannesburg Sud Africa 2196
Attenzione: Direttore della Lega
Ciascuna Parte potrà, previa comunicazione all’altra Parte, modificare gli indirizzi e i nomi sopra indicati.
12. VARIE.
12.1 Negoziazione della controversia.
Prima di avviare qualsiasi arbitrato in relazione a qualsiasi controversia, pretesa, domanda riconvenzionale, controversia, differenza o incomprensione derivante da o relativa all’interpretazione o all’applicazione di qualsiasi termine o disposizione del presente Contratto, una Parte dovrà fornire un avviso scritto
Pagina 30 di 46
all’altra Parte dell’esistenza di tale controversia. Le Parti si impegnano per un periodo di trenta
(30) giorni successivi a tale avviso avviare discussioni e negoziazioni in buona fede nel tentativo di risolvere tale controversia. Se, entro la fine di tale periodo di trenta (30) giorni, a meno che tale periodo non venga prorogato mediante mutuo accordo scritto tra le Parti, le Parti non sono state in grado di risolvere tale controversia, ciascuna Parte potrà avviare un arbitrato in conformità con le procedure stabilite nella Sezione 12.2 (Arbitrato). Le procedure specificate in questa sezione
12.1 (Negoziazioni della controversia) costituiscono una precondizione per l’avvio di un arbitrato da parte di una Parte, in relazione a controversie tra le Parti derivanti da o relative al presente Contratto o a un Ordine di acquisto; a condizione, tuttavia, che una Parte possa richiedere un’ingiunzione preliminare o altro provvedimento giudiziario preliminare, senza tentare di risolvere tale controversia come previsto nella presente Sezione 12.1 (Negoziazioni della controversia), se a suo giudizio tale azione è necessaria per evitare un danno irreparabile. Le Parti si sottomettono espressamente e irrevocabilmente alla giurisdizione dei tribunali di New York, New York, U.S.A. per qualsiasi provvedimento ingiuntivo. Inoltre, l’obbligo di tentare di risolvere una controversia in conformità con la presente Sezione 12.1 (Negoziazioni della controversia) non pregiudica il diritto di una Parte di risolvere il presente Contratto come previsto nella Sezione 6 del presente documento, e nessuna delle Parti sarà tenuta a seguire queste procedure prima di risoluzione dell’accordo. La mancata partecipazione di una delle Parti a discussioni e negoziazioni in buona fede nel tentativo di risolvere tale controversia non ritarderà la data
con cui l’altra Parte può avviare l’arbitrato ai sensi della presente Sezione 12.1 (Negoziazioni sulla controversia).
12.2 Arbitrato.
Qualsiasi controversia, supervisione o reclamo derivante da, relativo a o in connessione con il presente Contratto, anche in relazione alla formazione, applicabilità, violazione, risoluzione, validità o applicabilità dello stesso, o relativo all’arbitrabilità o all’ambito e all’applicazione della presente Sezione 12.2 ( Arbitrato), sarà definitivamente risolto mediante arbitrato. L’arbitrato sarà condotto da tre arbitri, in conformità con il Regolamento di Arbitrato della Camera di Commercio Internazionale (“ICC”). Il ricorrente dovrà nominare un arbitro nella sua richiesta di arbitrato. Il convenuto dovrà nominare un arbitro entro trenta (30) giorni dal ricevimento della richiesta di arbitrato. I due (2) arbitri nominati dalle Parti nomineranno un terzo arbitro, di concerto con le Parti, entro trenta (30)ngiorni dalla conferma dell’arbitro successivamente nominato. Il terzo arbitro fungerà da presidente del tribunale. Se uno qualsiasi dei tre (3) arbitri non viene nominato entro il termine sopra prescritto, la CCI nominerà l’arbitro o gli arbitri. La sede dell’arbitrato sarà New York, New York, Stati Uniti e sarà condotto in lingua inglese. Le Parti si impegnano a mantenere la riservatezza su tutti gli aspetti dell’arbitrato, compresa la sua esistenza, contenuto e risultato, e su tutte le comunicazioni, la corrispondenza e le prove relative al procedimento arbitrale. La sentenza di cui sopra sopravvivrà alla conclusione del procedimento arbitrale. Nonostante quanto sopra, una Parte può divulgare informazioni relative al procedimento arbitrale nella misura in cui la divulgazione sia richiesta per proteggere o perseguire un diritto legale relativo all’arbitrato; eseguire o contestare un lodo in procedimenti legali in buona fede; rispondere a un ordine obbligatorio in buona fede o a una richiesta di informazioni da parte di un ente governativo o di regolamentazione; effettuare una divulgazione richiesta dalle leggi sui titoli, dalle regole di una borsa valori o da altre leggi, regolamenti o regole simili; o cercare servizi legali, contabili o altri servizi professionali. I costi dell’arbitrato, comprese, a titolo esemplificativo, le ragionevoli spese legali delle Parti, saranno a carico di
Pagina 31 di 46
Parte o Parti soccombenti. Tuttavia, il tribunale arbitrale può ripartire tali costi tra le parti se ritiene che la ripartizione sia ragionevole, tenendo conto delle circostanze del caso. Il lodo arbitrale sarà definitivo e vincolante per le Parti, le quali si impegnano a dare esecuzione a qualsiasi lodo senza indugio. Il giudizio sul lodo può essere emesso da qualsiasi tribunale avente giurisdizione sul lodo o avente giurisdizione sulla parte interessata o sui suoi beni.
12.3 Pubblicità.
Una Parte non potrà utilizzare il nome, la denominazione commerciale, i marchi di servizio, i marchi commerciali, la veste commerciale o i loghi dell’altra Parte in comunicati pubblicitari, pubblicità o qualsiasi altra pubblicazione, senza il previo consenso scritto dell’altra Parte in ciascun caso.
12.4 Legge applicabile.
Tutte le controversie saranno regolate dalle leggi dello Stato di New York, USA, senza riguardo
,,- in conflitto con principi di legge diversi dalla Sezione 5-1401 della New York General Obligations Law, salvo che qualsiasi controversia riguardante l’arbitrabilità o l’ambito e l’applicazione di questa Sezione sarà regolata dal Federai Arbitration Act degli Stati Uniti.
12.5 Diritti di terzi.
(a) L’Acquirente accetta che i diritti applicabili concessi o forniti a Pfizer ai sensi del presente Contratto siano concessi o forniti anche alle Affiliate di Pfizer o a BioNTech nella misura in cui tali diritti si riferiscono a tali Affiliate o a BioNTech, incluso ma non limitato all’indennizzo di cui alla Sezione 8( a) (ciascuno un “Terzo Beneficiario” e congiuntamente i “Terzi Beneficiari”). Ciascun Beneficiario Terzo avrà il diritto di far rispettare i termini del presente Contratto; a condizione che, nella misura consentita dalla Legge e laddove ragionevolmente fattibile, qualsiasi reclamo, richiesta o azione da parte di qualsiasi Beneficiario Terzo sarà portata avanti da Pfizer stessa per conto del relativo Beneficiario Terzo.
(b) Eventuali perdite subite da un Beneficiario terzo non saranno trattate come indirette esclusivamente perché subite da un Beneficiario terzo e non direttamente da Pfizer.
12.6 Rapporto tra le parti.
Il rapporto qui stabilito tra l’Acquirente e Pfizer è esclusivamente quello di contraenti indipendenti. Nessuna delle Parti ha l’autorità di agire o stipulare accordi o dichiarazioni per conto dell’altra Parte. Il presente Contratto non è inteso a creare, e non dovrà essere interpretato come creazione, tra Pfizer e l’Acquirente, il rapporto tra mandante e agente, datore di lavoro e dipendente, joint venturer, co-partner, o qualsiasi altro rapporto simile, la cui esistenza è espressamente negato.
Pagina 32 di 46
12.7 Cessione; Effetto vincolante.
Né l’Acquirente né Pfizer potranno cedere alcuno dei propri diritti né delegare o subappaltare alcuno dei propri doveri e obblighi ai sensi del presente Contratto senza il previo consenso scritto dell’altra Parte, che potrà essere trattenuto a discrezione di tale Parte, a condizione che Pfizer, senza il consenso dell’Acquirente, possa assegnare, delegare o subappaltare qualsiasi dei suoi doveri e obblighi ai sensi del presente Contratto a un’Affiliata di Pfizer, BioNTech o un’Affiliata di BioNTech. Qualsiasi tentativo di cessione di diritti o delega o subappalto di compiti senza il previo consenso scritto dell’altra Parte sarà nullo e inefficace. Qualsiasi cessione, delega o subappalto acconsentita da una Parte per iscritto non solleverà l’altra Parte dalle sue responsabilità e obblighi ai sensi del presente documento e tale Parte cedente rimarrà responsabile nei confronti dell’altra Parte per la condotta e le prestazioni di ciascun cessionario, delegato e subappaltatore autorizzato ai sensi del presente documento. Il presente Contratto si applicherà, avrà effetto a beneficio e sarà vincolante per le Parti contraenti e i loro rispettivi successori e cessionari autorizzati. Le Parti convengono che il presente Contratto non è inteso da Pa11y a concedere alcun beneficio, diritto, privilegio, azione o rimedio a qualsiasi Persona o entità, partnership, azienda o società come beneficiario terzo o altrimenti ai sensi di qualsiasi teoria della legge.
12.8 Forza maggiore.
Nessuna delle Parti sarà responsabile per eventuali inadempimenti o ritardi nell’esecuzione, e nessuna delle Parti sarà ritenuta in violazione o inadempienza dei propri obblighi stabiliti nel presente Contratto, se, nella misura e per tutto il tempo in cui, tale inadempimento o il ritardo è dovuto a cause che vanno oltre il suo ragionevole controllo! e non ai suoi atti o omissioni, incluse, senza limitazione, cause quali cause di forza maggiore, disastri naturali, inondazioni, forti tempeste, terremoti, disordini civili, serrate, rivolte, ordini di qualsiasi tribunale o organo amministrativo, embargo, atti di governo (diverso dall’Acquirente), guerra (dichiarata o meno), atti di terrorismo, impatto su una Parte di un’epidemia di qualsiasi malattia o di un’epidemia o di una pandemia o altre cause simili (“Evento di Forza Maggiore”). Il mancato o l’incapacità di pagare non costituirà motivo di evento di forza maggiore ai sensi del presente Contratto. In caso di Evento di Forza Maggiore, la Parte impossibilitata o ritardata nell’esecuzione dovrà tempestivamente avvisare l’altra Parte e dovrà compiere sforzi commercialmente ragionevoli per evitare o ridurre al minimo il ritardo.
12.9 Separabilità.
Se ed esclusivamente nella misura in cui qualsiasi corte o tribuna! della giurisdizione competente ritiene che qualsiasi disposizione del presente Contratto sia inapplicabile in un ordine definitivo e inappellabile, tale disposizione inapplicabile verrà cancellata e il resto del presente Contratto non sarà influenzato da ciò. In tal caso, le Parti cercheranno in buona fede di sostituire qualsiasi disposizione inapplicabile del presente Contratto con una disposizione che sia applicabile e che si avvicini il più possibile all’espressione dell’intenzione della disposizione originale.
12.10 Mancata rinuncia; Rimedi.
Una rinuncia da parte di qualsiasi Parte a qualsiasi termine o condizione del presente Contratto in qualsiasi caso non sarà considerata o interpretata come una rinuncia a tale termine o condizione per il futuro, o a qualsiasi successiva violazione dello stesso. Tutti i rimedi specificati nel presente Contratto saranno cumulativi
Pagina 33 di 46
e in aggiunta a qualsiasi altro rimedio previsto dalla legge o dall’equità.
12.11 Ulteriori documenti.
Ciascuna Parte si impegna a sottoscrivere ulteriori documenti e ad adottare ulteriori misure che potrebbero essere ragionevolmente necessarie o desiderabili per realizzare gli scopi del presente Contratto.
12.12 Moduli.
Le Parti riconoscono che, durante la Durata, un modulo di conferma dell’Ordine di Acquisto o un documento di routine simile (collettivamente, “Moduli”) può essere utilizzato per implementare o gestire le disposizioni del presente Contratto. Le Parti convengono che i termini del presente Contratto prevarranno in caso di conflitto tra i termini del presente Contratto e i termini di tali Moduli, e qualsiasi termine aggiuntivo o diverso contenuto in tali Moduli non si applicherà al presente Contratto.
12.13 Intestazioni.
I titoli delle sezioni o di altre parti del presente Contratto sono inclusi nel presente documento solo per comodità di riferimento e non costituiranno parte del presente Contratto né modificheranno il significato del presente Contratto.
12.14 Controparti.
Il presente Contratto può essere stipulato in due o più copie, ciascuna delle quali costituirà un originale e tutte insieme costituiranno uno e lo stesso contratto, ed entreranno in vigore una volta firmato da ciascuna delle Parti contraenti e consegnato all’altra Parte in conformità con i mezzi indicati nella Sezione 11 (Comunicazioni) o con mezzi elettronici affidabili (con ricevuta confermata elettronicamente).
12.15 Consegna e conservazione elettronica.
La consegna di un Contratto firmato tramite mezzi elettronici affidabili, inclusi fax o e-mail (con ricevuta confermata elettronicamente), costituirà un metodo efficace di consegna del Contratto stipulato. Il presente Contratto può essere archiviato con mezzi elettronici e una copia originale o archiviata elettronicamente del presente Contratto può essere utilizzata per tutti gli scopi, incluso in qualsiasi procedimento volto a far valere i diritti o gli obblighi delle Parti contraenti.
Accordo.
12.16 Intero accordo; Modifiche.
Il presente Contratto, insieme a eventuali allegati ed emendamenti (e poiché tali allegati possono essere modificati, modificati, riformulati o sostituiti di volta in volta), che sono qui incorporati per riferimento, costituiscono l’intero accordo delle Parti rispetto al suo oggetto e si fonde e sostituisce tutte le discussioni e gli scritti precedenti in merito, incluso il Term Sheet vincolante. Salvo quanto diversamente indicato nel presente documento; nessuna modifica o alterazione del presente Contratto sarà vincolante per i Patti se non contenuta in un documento scritto firmato da un agente debitamente autorizzato per ciascun rispettivo Paity e
Pagina 34 di 46
sss?.J
specificatamente riferito a questo o ad esso.
12.17 Regola di costruzione.
Le Parti hanno partecipato congiuntamente alla negoziazione e alla stesura del presente Accordo. Nel caso in cui sorga un’ambiguità o una questione di intenti o di interpretazione, il presente Contratto sarà interpretato come se fosse stato redatto congiuntamente dalle Parti e non potrà sorgere alcuna presunzione o onere della prova a favore o sfavore di alcuna Parte in virtù della paternità di una qualsiasi delle disposizioni del presente accordo.
12.18 Lingua inglese.
Il presente Contratto sarà scritto ed eseguito, e tutte le altre comunicazioni ai sensi o in connessione con il presente Contratto dovranno essere in lingua inglese. Qualsiasi traduzione in qualsiasi altra lingua non costituirà una versione ufficiale della stessa e in caso di conflitto
nell’interpretazione tra la versione inglese e tale traduzione, la versione inglese prevarrà!.
12.19 Costi legali.
Ciascuna Parte sosterrà le proprie spese legali nella preparazione e conclusione del presente Accordo.
[firma alla pagina seguenteJPagina 35 di 46
IN FEDE DI CHE, le Parti hanno fatto sì che il presente Contratto fosse debitamente eseguito e consegnato a partire dalla data sopra scritta.
PFIZER LABORATORIES (PROPRIETARIO) LIMITATA
Redatto da HJI il 4 settembre 2023
B
Nome: Rhulani Nhlaniki
Titolo: Responsabile del cluster: SSA e Country Manager: Sud Africa
IL GOVERNO DELLA REPUBBLICA DEL SUDAFRICA AGIRE ATTRAVERSO IL DIPARTIMENTO NAZIONALE DELLA SALUTE DEL SUDAFRICA
01-04-2021
Titolo: Direttore Generale della Sanità
Pagina 36 di 46
EAS1ìl80078372.3 ·
sss
Allegato A – Specifiche
Da inserire successivamente alla Data di Efficacia
Pagina 37 di 46
RISERVATO
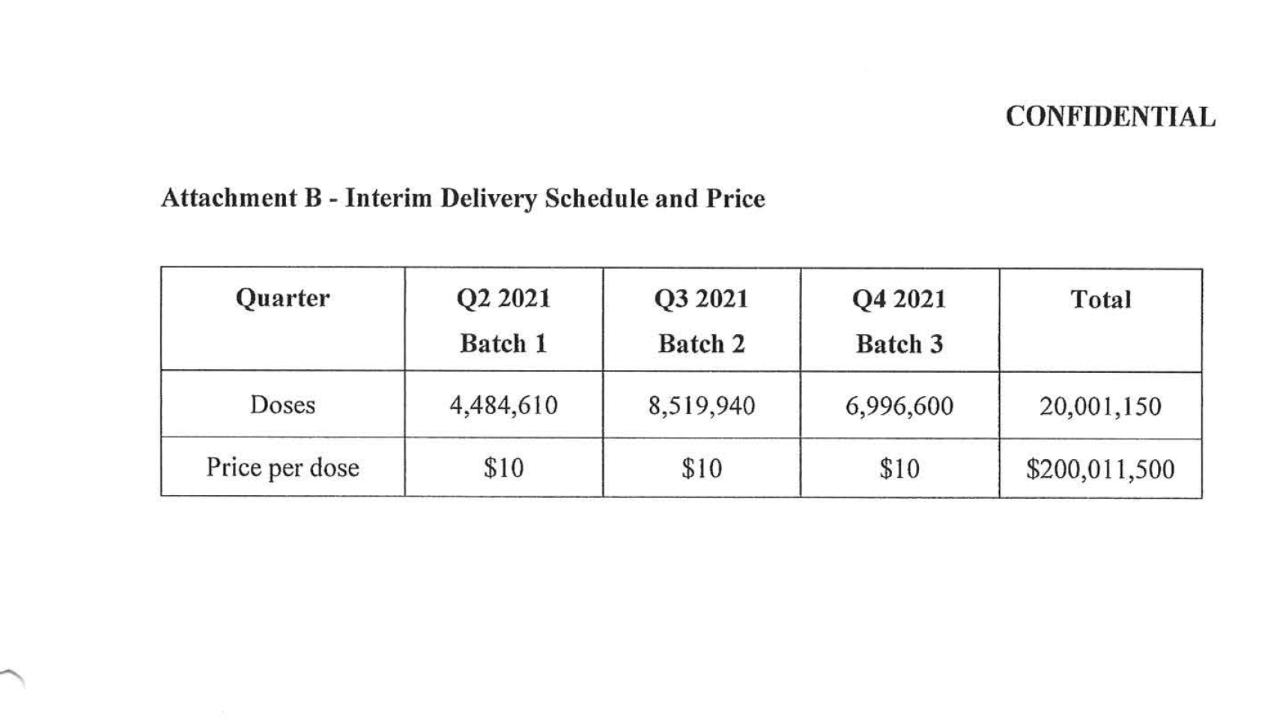
Pagina 38 di 46
Allegato C – Documentazione di Consegna Documentazione e Note di Consegna
Documentazione del mittente termico
Attualmente è previsto che con ogni spedizione dei Prodotti venga fornito:
I. Fogli informativi/Opuscoli – Cinque (5) fogli informativi piegati 3×2″ in un sacchetto di plastica
2. Brochure Pfizer – Uno (I) per contenitore termico contenente informazioni sulla conservazione e la movimentazione del prodotto, tra cui:
Inserto per la gestione del ghiaccio secco
Scheda dati di sicurezza (SDS) per ghiaccio secco
Istruzioni per la restituzione dei registratori GPS e del sistema di spedizione termica Un SOS autonomo per il ghiaccio secco
Etichetta vuota – scopo dell’etichetta vuota: consentire ai trasportatori di contrassegnare l’etichetta del ghiaccio secco per indicare che i contenitori della spedizione termica sono vuoti (non contenenti ghiaccio secco)
3. Etichetta di spedizione per la restituzione: una (1)
4. Etichetta di spedizione in uscita: una (I), etichetta standard sullo spedizioniere termico
5. Etichetta del contenuto: una (1) etichetta sul lembo interno, l’etichetta di prelievo riporta i dettagli del numero di vassoi di cartone presenti nello spedizioniere termico
Documentazione della prova di consegna
Attualmente Pfizer intende utilizzare il segnale di consegna del corriere come prova di consegna.
Documento di prova di consegna a cui è possibile accedere online in base al numero di tracciabilità. Vedere l’esempio UPS* di seguito:

*L’immagine della prova di consegna sopra riportata è solo un esempio.
Pagina 39 di 46
Allegato D – Specifiche di consegna
Specifiche di consegna, conservazione e movimentazione del prodotto
Le spedizioni arriveranno in un container termico per spedizioni a lunga distanza fornito da Pfizer in conformità con le Specifiche di etichettatura e imballaggio indicate nell’Allegato E (“Speditore termico”). Al momento, la confezione minima in qualsiasi spedizione sarà di un (1) vassoio con 195 fiale/1170 dosi di Prodotto.
L’Acquirente garantisce che all’orario previsto di arrivo presso il/i Luogo/i di Destinazione una persona dedicata sarà disponibile a ricevere il Prodotto, firmare l’accettazione della consegna e, immediatamente, entro e non oltre 24 ore dalla consegna, spegnere il registratore della temperatura situato nel Thermal Shipper, e:
(a) trasferire il Prodotto a:
i) un congelatore a temperatura ultrabassa (“ULT”) a -75 °C (+/- 15 °C); O
(ii) un frigorifero a 2-8 °C; O
(b) mantenere il Prodotto con una fornitura sufficiente di ghiaccio secco in conformità con i protocolli per il ri-ghiaccio indicati di seguito e tale ri-ghiaccio iniziale dovrà avvenire entro e non oltre 24 ore dalla firma dell’accettazione della consegna.
L’Acquirente riconosce le seguenti tempistiche di stabilità a partire dalla Data di efficacia:
• Il Prodotto ha una durata di conservazione fino a 6 mesi se conservato a una temperatura costante di -75 °C (+/- 15 °C)
• Il Thermal Shipper può essere utilizzato come deposito temporaneo per un massimo di 30 giorni, a condizione che il ghiaccio secco venga rifornito al ricevimento e almeno ogni cinque (5) giorni secondo le linee guida di Pfizer.
• Il Prodotto ha una vita effettiva fino a 5 giorni se conservato a temperatura di frigorifero compresa tra 2 e 8°C
• Una volta scongelato e ricostituito, il Prodotto può essere conservato fino a 6 ore a temperatura ambiente standard (2-25°C)
Qualsiasi ulteriore spedizione o distribuzione del Prodotto da parte dell’Acquirente dal Luogo(i) di destinazione dovrà avvenire tramite un servizio di spedizione certificato, o l’uso del proprio sistema logistico, che garantirà la consegna il giorno successivo dal Luogo(i) di destinazione al punto di utilizzo del Prodotto; e l’Acquirente sarà responsabile di garantire il rispetto continuo delle Buone Pratiche di Distribuzione (“GDP”), compresi i requisiti della catena del freddo per qualsiasi ulteriore distribuzione successiva alla consegna in un Luogo di Destinazione che non sia un punto di utilizzo del Prodotto. In tutti i casi, l’Acquirente dovrà garantire che tutti i Prodotti vengano trasportati tramite un sistema di spedizione qualificato GDP. L’Acquirente riconosce che il Thermal Shipper (compresi i dispositivi di monitoraggio della temperatura Pfizer) non sarà utilizzato per alcun trasporto e/o distribuzione sul mercato da parte dell’Acquirente e sarà restituito a Pfizer in conformità all’Allegato F – Restituzione e smaltimento dei materiali del prodotto del presente Accordo. In base ai termini del Contratto, tutti i costi associati alla ricezione, alla movimentazione, all’immagazzinamento e all’ulteriore consegna del Prodotto saranno a carico dell’Acquirente, e l’Acquirente dovrà garantire che tutti i luoghi in cui il Prodotto viene consegnato da o per conto dell’Acquirente, saranno essere conformi ai requisiti stabiliti nel presente Allegato D e dovranno soddisfare gli standard ivi stabiliti.
Pagina 40 di 46
Protocolli per il disimballaggio del prodotto e il re-icing: vedere gli allegati I e 2 dell’allegato D
Requisiti del luogo di consegna:
I. Punti di autorizzazione all’immissione in commercio e/o approvazione condizionata, pre-approvazione, post-approvazione con congelatore ULT a -75 °C (+/- 15 °C)
2. Autorizzazione all’immissione in commercio e/o Approvazione Condizionata, pre-approvazione, post-approvazione
punti di vaccinazione con accesso sufficiente e fornitura di ghiaccio secco
3. Autorizzazione all’immissione in commercio e/o Approvazione Condizionata, punti di vaccinazione pre-approvazione, post-approvazione con frigorifero a 2-8°C
Allegato D – Specifiche di consegna
Allegato 1 – Disimballaggio e re-icing: Speditore termico A
Spedizione tramite Apdf
Allegato D – Specifiche di consegna
Allegato 2 – Disimballaggio e re-icing: Speditore termico B
Spedizione per B.pdf
Istruzioni per la preparazione e la somministrazione del vaccino Rimozione delle fiale da scongelare
• Dalla conservazione, prelevare una fiala ogni 6 riceventi secondo il programma vaccinale previsto.
• Le fiale possono essere conservate in frigorifero per 5 giorni (120 ore).
Diluire il vaccino
• Procurarsi una soluzione iniettabile di cloruro di sodio allo 0,9%, da utilizzare come diluente. Non utilizzare diluenti alternativi.
• Diluire la fiala scongelata aggiungendo 1,8 ml di soluzione iniettabile di cloruro di sodio allo 0,9% nella fiala.
• Assicurarsi che la pressione della fiala sia equalizzata aspirando 1,8 ml di aria nella siringa di diluente vuota prima di rimuovere l’ago dalla fiala.
Pagina 41 di 46
Preparazione della dose
• Aspirare 0,3 ml della soluzione di dosaggio diluita in una nuova siringa dosatrice sterile con un ago adatto per l’iniezione intramuscolare.
• Per ogni dose aggiuntiva, utilizzare una siringa e un ago sterili nuovi e garantire la via! il tappo viene pulito con antisettico prima di ogni prelievo.
Somministrazione dei vaccini
• Le fiale diluite devono essere utilizzate entro 6 ore dal momento della diluizione e conservate a una temperatura compresa tra 2 e 25 °C (35-77 °F).
• Una dose singola da 30 mcg/0,3 ml è seguita da una seconda dose 21 giorni dopo.
Pagina 42 di 46
Allegato E – Specifiche di Etichettatura e Imballaggio
Specifiche di etichettatura del prodotto
Le etichette dei prodotti per l’imballaggio primario, secondario e terziario saranno condivise più vicino ai documenti normativi nazionali.
Attualmente è previsto che quanto segue faccia parte dell’artwork iniziale del prodotto:
Imballaggio primario (flacone):
• Codice a barre lineare: esegue la scansione come Global Tracie Item Number (GTIN) che include il numero NDC (National Drug Code) leggibile dall’uomo.
Imballaggio secondario (vassoio di cartone):
• Codice a barre lineare: esegue la scansione come numero GTIN che include il numero NDC leggibile dall’uomo.
• Codice QR: una volta scansionato, questo codice si collega a una pagina di destinazione in cui è disponibile una copia delle schede informative saranno disponibili l’operatore sanitario, il paziente/destinatario e il foglietto illustrativo (ovvero il foglio illustrativo elettronico).
Leggi le ultime notizie su www.presskit.it
Mente in Europa: Gli SMS tra Ursula von der Leyen e Pfizer non saranno pubblicati, stop dal 55% dei parlamentari UE
Seguici su Facebook https://www.facebook.com/presskit.it
Seguici su Sfero: https://sfero.me/users/presskit-quotidiano-on-line
Seguici su Telegram https://t.me/presskit






