“L’EMA [38] richiede che, in caso di segni di espressione a lungo termine, l’integrazione genomica involontaria e l’oncogenesi debbano essere studiate”, scrive la ricercatrice indipendente Helene Banoun su “International Journal of Molecular Sciences”.
“La durata e l’espressione devono essere determinate mediante RT-PCR e test immunologici e/o test per rilevare la proteina funzionale. La sovraespressione del transgene deve essere monitorata [38].
Questo avrebbe dovuto essere controllato, dato che possono essere prodotte grandi quantità di proteina spike, a volte in eccesso rispetto a quelle circolanti in quelli con grave COVID-19.
Un confronto delle concentrazioni di picco raggiunte durante la malattia e dopo la vaccinazione mostra che,
- durante il COVID-19 grave, la concentrazione mediana osservata è di 50 pg/mL, con massimi a 1 ng/mL.
- Durante una grave infezione da COVID-19, è possibile rilevare livelli fino a 135 pg/mL di picco S1, più comunemente tra 6 e 50 pg/mL.
- Dopo la vaccinazione con concentrazioni di vaccino a mRNA fino a 150 pg/mL sono comunemente osservati,
- ma possono raggiungere 10 ng/mL in individui con trombocitopenia indotta da vaccino [55,59]”.
Questa ampia biodistribuzione avrebbe dovuto rendere essenziale l’esecuzione dei controlli richiesti per i prodotti di terapia genica (GTP).
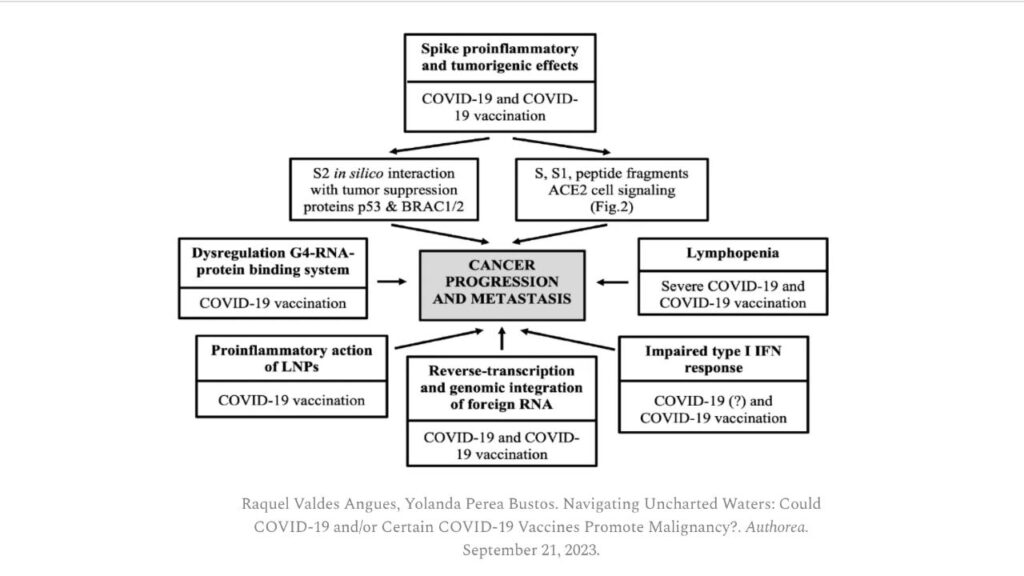
“Avrebbero dovuto essere condotti studi di cancerogenicità, tumorigenicità e soppressione immunitaria, poiché due studi hanno suggerito che i vaccini a mRNA possono indurre immunotolleranza [75,76].
Inoltre, la proteina spike può interagire con il soppressore tumorale [77,78] (p. 53).
Sarebbe quindi saggio esplorare l’effetto tumorigenico in vivo e monitorare eventuali tumori sviluppati da individui vaccinati a lungo termine, soprattutto perché è stato suggerito che i tumori possono essere riattivati dai vaccini a mRNA [79,80,81] o possono svilupparsi dopo la vaccinazione con mRNA [82,83,84,85,86].
4.5. Vaccinovigilanza
Note
38. EMA GTP 2018 CAT/80183/2014 Adoption by CHMP 22 March 2018 Guideline on the Quality, Non-Clinical and Clinical Aspects of Gene Therapy Medicinal Products. Available online: https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-quality-non-clinical-clinical-aspects-gene-therapy-medicinal-products_en.pdf (accessed on 14 June 2023).
55. Cognetti, J.S.; Miller, B.L. Monitoring Serum Spike Protein with Disposable Photonic Biosensors Following SARS-CoV-2 Vaccination. Sensors 2021, 21, 5857. [Google Scholar] [CrossRef]
59. Ogata, A.F.; Maley, A.; Wu, C.; Gilboa, T.; Norman, M.; Lazarovits, R.; Mao, C.-P.; Newton, G.; Chang, M.; Nguyen, K.; et al. Ultra-Sensitive Serial Profiling of SARS-CoV-2 Antigens and Antibodies in Plasma to Understand Disease Progression in COVID-19 Patients with Severe Disease. Clin. Chem. 2020, 66, 1562–1572. [Google Scholar] [CrossRef]
75. Irrgang, P.; Gerling, J.; Kocher, K.; Lapuente, D.; Steininger, P.; Habenicht, K.; Wytopil, M.; Beileke, S.; Schäfer, S.; Zhong, J.; et al. Class switch toward noninflammatory, spike-specific IgG4 antibodies after repeated SARS-CoV-2 mRNA vaccination. Sci. Immunol. 2023, 8, eade2798. [Google Scholar] [CrossRef]
76. Gao, F.X.; Wu, R.X.; Shen, M.Y.; Huang, J.J.; Li, T.T.; Hu, C.; Luo, F.Y.; Song, S.Y.; Mu, S.; Hao, Y.N.; et al. Extended SARS-CoV-2 RBD booster vaccination induces humoral and cellular immune tolerance in mice. iScience 2022, 25, 105479. [Google Scholar] [CrossRef]
77. Singh, N.; Bharara Singh, A. S2 subunit of SARS-nCoV-2 interacts with tumor suppressor protein p53 and BRCA: An in silico study. Transl. Oncol. 2020, 13, 100814. [Google Scholar] [CrossRef]
78. Kyriakopoulos, A.M.; Nigh, G.; McCullough, P.A.; Seneff, S. Mitogen Activated Protein Kinase (MAPK) Activation, p53, and Autophagy Inhibition Characterize the Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Spike Protein Induced Neurotoxicity. Cureus 2022, 14, e32361. [Google Scholar] [CrossRef]
79. Goldman, S.; Bron, D.; Tousseyn, T.; Vierasu, I.; Dewispelaere, L.; Heimann, P.; Cogan, E.; Goldman, M. Rapid Progression of Angioimmunoblastic T Cell Lymphoma Following BNT162b2 mRNA Vaccine Booster Shot: A Case Report. Front. Med. 2021, 8, 798095. [Google Scholar] [CrossRef]
80.Bae, E.; Bae, S.; Vays, M.; Abdelwahed, M.; Sarkar, K.; Bae, S.; Vaysblat, M. Development of High-Grade Sarcoma After Second Dose of Moderna Vaccine. Cureus 2023, 15, e37612. [Google Scholar] [CrossRef]
81. Revenga-Porcel, L.; Peñate, Y.; Granados-Pacheco, F. Anaplastic large cell lymphoma at the SARS-CoV2 vaccine injection site. J. Eur. Acad. Dermatol. Venereol. 2023, 37, e32–e34. [Google Scholar] [CrossRef] [PubMed]
82. Zamfir, M.-A.; Moraru, L.; Dobrea, C.; Scheau, A.-E.; Iacob, S.; Moldovan, C.; Scheau, C.; Caruntu, C.; Caruntu, A. Hematologic Malignancies Diagnosed in the Context of the mRNA COVID-19 Vaccination Campaign: A Report of Two Cases. Medicina 2022, 58, 874. [Google Scholar] [CrossRef]
83. Mizutani, M.; Mitsui, H.; Amano, T.; Ogawa, Y.; Deguchi, N.; Shimada, S.; Miwa, A.; Kawamura, T.; Ogido, Y. Two cases of axillary lymphadenopathy diagnosed as diffuse large B-cell lymphoma developed shortly after BNT162b2 COVID-19 vaccination. J. Eur. Acad. Dermatol. Venereol. 2022, 36, e613–e615. [Google Scholar] [CrossRef] [PubMed]
84. Cavanna, L.; Grassi, S.O.; Ruffini, L.; Michieletti, E.; Carella, E.; Palli, D.; Zangrandi, A.; Inzerilli, N.; Bernuzzi, P.; Di Nunzio, C.; et al. Non-Hodgkin Lymphoma Developed Shortly after mRNA COVID-19 Vaccination: Report of a Case and Review of the Literature. Medicina 2023, 59, 157. [Google Scholar] [CrossRef] [PubMed]
85. Panou, E.; Nikolaou, V.; Marinos, L.; Kallambou, S.; Sidiropoulou, P.; Gerochristou, M.; Stratigos, A. Recurrence of cutaneous T-cell lymphoma post viral vector COVID-19 vaccination. J. Eur. Acad. Dermatol. Venereol. 2022, 36, e91–e93. [Google Scholar] [CrossRef] [PubMed]
86. Sekizawa, A.; Hashimoto, K.; Kobayashi, S.; Kozono, S.; Kobayashi, T.; Kawamura, Y.; Kimata, M.; Fujita, N.; Ono, Y.; Obuchi, Y.; et al. Rapid progression of marginal zone B-cell lymphoma after COVID-19 vaccination (BNT162b2): A case report. Front. Med. 2022, 9, 963393. [Google Scholar] [CrossRef]
Leggi le ultime notizie su www.presskit.it
Può interessarti anche: Vaccini: nessuna ispezione nelle fiale finali, da qui il problema dei lotti che hanno più effetti avversi?
Può interessarti anche: Vaccini Covid: circa il 5% di tutti i lotti è responsabile del 90% di tutti gli effetti collaterali segnalati.
Seguici su Facebook https://www.facebook.com/presskit.it
Seguici su Sfero: https://sfero.me/users/presskit-quotidiano-on-line
Seguici su Telegram https://t.me/presskit